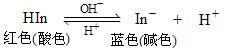| 酸碱中和滴定误差分析及酸碱指示剂的选择 |
主编:黄冈中学化学集体备课组
一、酸碱中和滴定误差分析
以HCl滴定NaOH溶液这个实验讨论,
依据:
练习:(1)未用标准液润洗滴定管。(偏大)
(2)用待测液润洗锥形瓶。(偏大)
(3)读数
(4)滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失。(偏大)
(5)不小心将标准液滴在锥形瓶的外面。(偏大)
(6)指示剂(可当作弱酸)用量过多。(偏小)
(7)滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出。(偏小)
(8)碱式滴定管(量待测液用)用蒸馏水洗涤后,直接注入待测液。(偏小)
(9)锥形瓶洗涤后未干燥,直接盛待测液。(无影响)
(讲)用HCl滴NaOH溶液,求NaOH的浓度,c(NaOH)是否准确,除了取液读数操作无误后,还取决于滴定终点的判断是否准确。
二、酸碱指示剂的选择
酸碱指示剂的变色范围:
酸碱指示剂是一些有机弱酸或弱碱,在溶液中存在电离平衡,而其分子与电离出的离子呈不同的颜色,因此,pH改变时,由于分子、离子含量的变化,会引起溶液颜色的变化。如石蕊(以HIn表示)的电离平衡和颜色变化:
指示剂的颜色变化是在一定pH范围内发生的,几种常用指示剂的变色范围如下:
指示剂
变色范围
(pH)
颜色
酸色
碱色
甲基橙
3.1~4.4
红
黄
石蕊
5.0~8.0
红
蓝
酚酞
8.2~10.0
无
红
(提问)0.1mol·L-1 HCl滴NaOH时,什么时候停止滴定?(红色恰好褪去的那一点)
(讲)即指示剂恰好变色的那一点,根据酚酞的变色范围,此时溶液的pH大约为多少?(pH在8左右)
(提问)根据化学方程式,HCl与NaOH恰好完全中和时,溶液的pH为多少?
HCl+NaOH=NaCl+H2O,pH=7
(讲)通过刚才的分析,我们认识到指示剂变色的那一点(即实际操作中确定滴定结束的那一点)与理论上的碱恰好完全反应的那一点,并不一致。大家在常见的指示剂里找一找,有没有恰好在pH=7变色的指示剂?
(学生)没有
(讲)基本上没有在酸碱恰好完全中和的那一点变色的指示剂,因此要求这两点越接近越好。这两点在中和滴定中有各自的专门名称。
1、化学计量点:酸与碱恰好完全反应的点。
(举例)HCl滴NaOH
HCl+NaOH=NaCl+H2O pH=7的那一点 化学计量点的pH并不都为7。
如:HCl滴NH3·H2O
HCl+NH3·H2O=NH4Cl+H2O,pH<7
NaOH滴CH3COOH
NaOH+CH3COONa=CH3COONa+H2O,pH>7
2、滴定终点:指示剂恰好变色的点
(讲)为了使中和滴定的结果准确,化学计量点与滴定终点越接近越好。
由于不同的酸与不同碱反应的化学计量点有差别,因此选用的指示剂也就有区别,如何根据化学计量点选指示剂呢,以具体的实例分析。
例:0.1mol·L-1 HCl滴定20mL 0.1mol·L-1 NaOH溶液
(1)滴定前,pH=________
(2)滴入20mL 0.1mol·L-1 HCl溶液时,pH=________。
(3)少加入1滴HCl溶液,pH=________。
(4)多加入1滴HCl,pH=________。
解:
(1)13
(2)7
(3)
pH=10。
(4)
pH=4。
(讲)达到化学计量点时,多1滴与少1滴的pH值改变有6个单位,曲线呈现近似垂直的一段,表明溶液的pH有一个突然的改变,这种pH值的突然改变称为滴定突跃。滴定突跃有重要的意义,它是选择指示剂的依据,凡变色点的pH处于滴定突路所在的pH范围内的指示剂均适用。
选择指示剂时,不仅要求指示剂的变色点越接近化学计量点越好,还要求指示剂显示色要灵敏,变色范围越窄越好,由于人眼对从浅色→深色的观察更为灵敏,因此在这个实验中用甲基橙比用酚酞作指示剂更好。
3、指示剂选择的原则:
①指示剂的变色点尽可能接近化学计量点。
②指示剂颜色变化明显,易于观察判断。
③指示剂的变色范围越窄越好。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -