1、酸碱恰好中和时( )
A.酸与碱的物质的量一定相等
B.酸所能提供的H+与碱所能提供的OH-的物质的量相等
C.酸与碱的质量相等
D.溶滴呈中性
2、标准状况下充满NH3的烧瓶做完喷泉实验后得到的氨水溶液,用标准盐酸来滴定这种氨水测定它的准确浓度,现有以下四种浓度的盐酸,最合适的是( )
A.2.50mol·L-1 B.0.250mol·L-1
C.0.025mol·L-1 D.1mol·L-1
3、配制一定物质的量浓度的NaOH标准溶液,用于测定未知浓度的盐酸,下列操作中会造成所测盐酸浓度偏低的是( )
①所用烧碱已部分潮解;②NaOH溶解后未冷却至室温就立即转移入容量瓶并定容;③定容后,溶液液面最高点与刻度线在同一水平面;④向容量瓶中一次性转移NaOH溶液
A.①② B.②③
C.②③④ D.①②③④
4、用0.1mol·L-1 NaOH标准溶液滴定100mL 0.1mol·L-1盐酸时,如果滴定误差在0.1%以内;反应完毕,溶液的pH范围为( )
A.6.9~7.1 B.3.3~10.7
C.4.3~9.7 D.6~8
5、在25℃时,用0.125mol·L-1标准盐酸溶液滴定25.00mL未知浓度的NaOH溶液所得的滴定曲线如图所示,图中K点代表的pH为( )
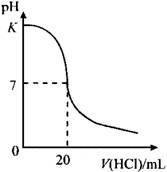
A.13 B.12
C.10 D.11
6、已知当NH4Cl溶液的浓度小于0.1mol·L-1时,其pH>5.1。现用0.1mol·L-1的盐酸滴定10mL 0.05mol·L-1的氨水,用甲基橙作指示剂,达到终点时所用盐酸的量应是( )
A.10mL B.5mL
C.大于5mL D.小于5mL
7、以酚酞作指示剂,对某新制NaOH溶液进行中和滴定实验,数据记录如下表:
|
待测液 |
消耗标准盐酸(0.01mol·L-1)的体积 |
① |
20mL NaOH溶液 |
V1 mL |
② |
20mL NaOH溶液+10mL H2O |
V2 mL |
③ |
敞口隔夜放置的20mL NaOH溶液 |
V3 mL |
则该新制的NaOH溶液的浓度合理的是( )
8、下列有关中和滴定的叙述中正确的是( )
A.中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2~3mL
B.滴定管、锥形瓶均先水洗后润洗
C.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内液面变化
D.若用标准盐酸滴定待测NaOH溶液,滴定前仰视,滴定后俯视,则测定值偏大
9、如图是对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图象。依据图象推出盐酸和NaOH溶液的物质的量浓度是下表内各组中的( )
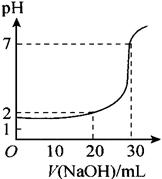
|
A |
B |
C |
D |
c(HCl)/mol·L-1 |
0.12 |
0.04 |
0.03 |
0.09 |
c(NaOH)/mol·L-1 |
0.04 |
0.12 |
0.09 |
0.03 |
10、乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4·xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关的学习任务。
该组同学的研究课题是:探究测定草酸晶体(H2C2O4·xH2O)中x值。通过查阅资料和网络查询得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定。
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260g纯草酸晶体,将其配成100.00mL水溶液为待测液。
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4。
③用浓度为0.1000mol·L-1的KMnO4标准液进行滴定,达到终点时消耗10.00mL。
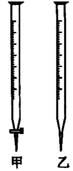
(1)滴定时,将KMnO4标准液装在如图中的__________(填“甲”或“乙”)滴定管中。
(2)本实验滴定达到终点的标志可以是______________________________。
(3)通过上述数据,求得x=__________。
讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会__________(填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会__________。
11、欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。
请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10mL,滴定后液面如图,则此时消耗标准溶液的体积为__________。
(2)乙学生做了三组平行实验,数据记录如下:
实验序号 |
待测NaOH溶液的体积/mL |
0.1000mol·L-1盐酸的体积/mL |
滴定前刻度 |
滴定后刻度 |
1 |
25.00 |
0.00 |
26.11 |
2 |
25.00 |
1.56 |
31.30 |
3 |
25.00 |
0.22 |
26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为__________(小数点后保留四位),达到滴定终点的标志是____________________。
(3)以下操作造成测定结果偏高的是__________。
A.配制待测溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装未知液的锥形瓶用蒸馏水润洗后,再用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗酸式滴定管