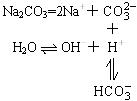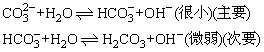| 盐类的水解(强酸弱碱盐) |
主编:黄冈中学化学集体备课组
(引)前面我们学过Na2CO3,俗称“纯碱”,属于盐,为什么叫“碱”呢?酸溶于水显酸性,碱溶于水显碱性,盐溶于水显什么性呢?
(展示)NaCl、Na2CO3、NaHCO3、NH4Cl、Na2SO4、CH3COONa、(NH4)2SO4
用pH试纸测溶液的pH值:
NaCl:pH=7 Na2SO4:pH=7
Na2CO3:pH=12 CH3COONa:pH=8
NaHCO3:pH=10 (NH4)2SO4:pH=6
NH4Cl:pH=5
(讲)盐溶液并不都显中性,强酸强碱盐溶液显中性,强酸弱碱盐溶液显酸性,强碱弱酸盐溶液呈碱性。溶液呈酸性、碱性取决于溶液中c(H+)和c(OH-)的相对大小。
是什么原因造成不同类型的盐溶液中c(H+)和c(OH-)的差异呢?
用NaAc分析此过程:
NaAc=Na++Ac-
H2O
OH-+H+
(讲)溶液中H+与Ac-会相对碰撞结合形成弱电解质HAc,这样打破了水的电解衡,使水的电离平衡向正反应方向移动,促进了水的电离,但由于电离出来的H+不断被消耗,而OH-一直不断增多,最终使得溶液中c(OH-)> c(H+),溶液呈碱性。像NaAc这样,由盐电离出来的弱离子与水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。
一、盐类的水解
(板书)NaAc水解的反应:
(讲)盐类水解为酸碱中和反应的逆反应,因此进行的程度不大。一般来说,中和和水解的这一系列中,中和反应占主导地位。因此一般认为酸碱中和反应是进行的很完全的,水解反应很微弱。
由于酸碱中和反应为放热反应,则盐类水解为吸热反应,温度升高,有利于水解。
(板书)Ac-+H2O
HAc+OH-
∴盐类水解的实质为:盐中的弱离子与水结合生成弱电解质,破坏了水的电离平衡状态,促进了水的电离。
CH3COONa为一元弱酸强碱盐,若为多元弱酸强碱盐呢?
Na2CO3溶液为何显碱性呢?
(第一步水解程度小,第二步水解程度更小)
板书:
强碱弱酸盐(碱性);强酸弱碱盐(酸性)。
(盐类水解的程度很小,一般不写气体和沉淀)。
练习:(1)写出Na2S水解的离子方程式
S2-+H2O
HS-+OH-
HS-+H2O
H2S+OH-
(2)NaHS水解的离子方程式
HS-+H2O
H2S+OH-
(3)KF水解的离子方程式
F-+H2O
HF+OH-
(4)Na3PO4水解的离子方程式
总结:盐类水解的实质为盐电离出来的弱离子与水电离出来的H+和OH-结合生成弱电解质(弱酸、弱碱、两性氢氧化合物),促进了水的电离。
例:pH=9的NaOH和NaAc两溶液中,由水电离出来的c(OH-)分别为________和________。
解:
pH=9的NaOH和NaAc溶液中:
c(H+)=10-9mol·L-1
c(OH-)=10-5mol·L-1
NaOH溶液中,c(H+)水=10-9mol·L-1,c(OH-)水=10-9mol·L-1。
NaAc溶液中,c(OH-)=10-5mol·L-1,c(H+)水= c(OH-)水=10-5mol·L-1。
练习:pH=3的酸溶液与pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是( )
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液与弱碱溶液反应
D.一元强酸和一元强碱溶液反应
答案:B
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -