1、有关盐类水解的说法不正确的是( )
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆反应
C.盐类水解的结果使盐溶液不一定呈中性
D.Na2CO3溶液中,c(Na+)是c(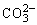 )的2倍
)的2倍
2、下列属于水解离子方程式的是( )

3、常温下,在pH=11的某溶液中,由水电离出的c(OH-)可能为( )
①1.0×10-3mol·L-1 ②1.0×10-6 mol·L-1
③1.0×10-7 mol·L-1 ④1.0×10-11 mol·L-1
A.①③ B.③
C.④ D.①④
4、已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol·L-1的碘酸(HIO3)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则对高碘酸和碘酸酸性强弱判断正确的是( )
A.高碘酸和碘酸都是强酸
B.高碘酸和碘酸都是弱酸
C.高碘酸是弱酸,碘酸是强酸
D.高碘酸是强酸,碘酸是弱酸
5、下列说法中正确的是( )
A.所有酸式盐的水溶液都显酸性
B.可溶性碳酸盐都能水解
C.钾盐、钠盐和硝酸盐不能水解
D.硝酸钠水溶液显中性
6、常温下,在pH都是9的NaOH和CH3COONa两种溶液中,设由水电离的c(OH-)分别为a mol·L-1与b mol·L-1,则a与b的关系为( )
A.a>b B.a=10-4b
C.b=10-4a D.a=b
7、有pH分别为8、9、10的三种相同物质的量浓度的盐溶液NaX、NaY、NaZ,以下说法中不正确的是( )
A.在三种酸HX、HY、HZ中以HX酸性相对最强
B.HX、HY、HZ三者均为弱酸
C.在X-、Y-、Z-三者中,以Z-最易发生水解
D.中和1mol HY酸,需要的NaOH稍小于1mol
8、下列离子方程式属于盐的水解,且书写正确的是( )
A.FeCl3溶液:Fe3++3H2O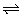 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B.NaHS溶液:HS-+H2O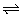 H2S+OH-
H2S+OH-
C.Na2CO3溶液: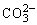 +2H2O
+2H2O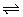 H2CO3+2OH-
H2CO3+2OH-
D.NH4Cl溶液: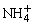 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
9、NH4Cl溶于重水后,产生的一水合氨和水合离子正确的是( )
A.NH2D·H2O和D3O+ B.NH3·D2O和HD2O+
C.NH3·HDO和D3O+ D.NH2D·HDO和H2DO+
10、物质的量浓度相同的下列溶液,由水电离出的c(H+)由大到小的顺序是( )
①NaHSO4 ②NaHCO3 ③Na2CO3 ④Na2SO4
A.④③②① B.①②③④
C.③②④① D.③④②①
11、常温时将pH=2的某酸HnA与pH=12的某碱B(OH) m等体积混合后,溶液的pH=6。
(1)写出生成的正盐的化学式为_____________。
(2)该盐中存在着一定水解的离子,该离子水解的离子方程式为______________。
(3)简述该混合液呈酸性的原因:_____________。
12、现有下列电解质溶液:①Na2CO3 ②NaHCO3 ③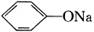 ④CH3COONH4 ⑤NH4HCO3
④CH3COONH4 ⑤NH4HCO3
(1)在这五种电解质溶液中,既能与盐酸又能与烧碱溶液反应的是(填写序号) _____________。
(2)已知酸性H2CO3>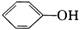 >
>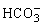 。常温下,物质的量浓度相同的①、②、③溶液,pH由大到小的顺序为(填写序号) _____________。
。常温下,物质的量浓度相同的①、②、③溶液,pH由大到小的顺序为(填写序号) _____________。
(3)写出⑤与足量NaOH溶液混合加热的离子方程式_____________。
(4)已知常温下CH3COONH4溶液呈中性,根据这一事实推测⑤溶液的pH_____________7(填“>”、“=”或“<”),理由是_____________。
13、25℃时0.1 mol·L-1的醋酸溶液的pH约为3,当向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大了,因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
(1)为了验证上述哪种解释正确,继续做如下实验:向1mol·L-1的醋酸溶液中加入少量下列物质中的_____________ (填写编号),然后测定溶液的pH(已知25℃时,CH3COONH4溶液呈中性)。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若_____________的解释正确(填“甲”或“乙”),溶液的pH应_____________ (填“增大”、“减小”或“不变”)。
(3)常温下将0.010 mol CH3COONa和0.002 mol HCl溶于水,配制成1 L混合溶液,判断:
①溶液中共有_____________种不同的粒子(指分子和离子)。
②其中有两种离子的物质的量之和一定等于0.010 mol,它们是_____________和_____________。
③溶液中n(CH3COO-)+n(OH-)-n(H+)=_____________mol。