例1、(全国卷I)用0.1mol·L—1的盐酸滴定0.1mol·L—1的氨水,在滴定过程中不可能出现的结果是( )
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)
解析:
溶液中的溶质有3种可能:①NH4Cl,NH4Cl水解使溶液呈酸性,则D正确; ②NH4Cl和HCl, 没有符合的选项 ③NH4Cl和NH3·H2O,此时溶液可能呈酸性,则B正确;可能碱性,则A正确。
答案:C
 例2、(安徽)向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是( )
例2、(安徽)向体积为0.05mol·L-1CH3COOH溶液中加入体积为Vb的0.05mol·L-1KOH溶液,下列关系错误的是( )
 A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
A.Va>Vb时:c (CH3COOH) +c (CH3COO-)>c (K+)
 B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)
B.Va=Vb时:c (CH3COOH) +c (H+)>c (OH-)
 C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+)
C.Va<Vb时:c (CH3COO-)>c (K+)> c (OH-)> c (H+)
 D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
D.Va与Vb任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-)
解析:
考查的是电解质溶液中各种守恒关系和离子浓度比较,题型比较保守,此题的解题方法是先让CH3COOH和KOH反应,然后找到反应后的溶质。A项:Va>Vb,反应后溶质为CH3COOH和CH3COOK的混合物,A正确。B项:Va=Vb,反应后溶质为CH3COOK,根据质子守恒,可得B正确。C项:Va<Vb,反应后溶质为CH3COOK和KOH混合物,可知c(K+)>c(CH3COO-),C错。D项:为电荷守恒,D正确。
 答案:C
答案:C
例3、(北京)有4种混合溶液,分别由等体积0.1 mol/L的2种溶液混合而成:①CH3COONa与HCl;②CH3COONa与NaOH;③CH3COONa与NaCl;④CH3COONa与NaHCO3 。下列各项排序正确的是
。下列各项排序正确的是 ( )
( )
A.pH:②>③>④>①
B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④
D.c(CH3COOH):①>④>③>②
解析:
四种溶液有共同的成分CH3COONa,比较溶液的酸碱性就比较另一种成分即可,0.1mol/L的四种溶液HCl(强酸)、NaOH(强碱)、NaCl(中性盐)、NaHCO3(强碱弱酸盐)的pH关系:②>④>③>①,A错误;c(H+)关系:①>③>④>②,C错误;CH3COONa水解呈碱性,另一种溶液碱性越强,越抑制醋酸根水解,c(CH3COO-)浓度越大,所以c(CH3COO-)浓度关系和pH关系相同:②>④>③>①,B对;CH3COONa水解呈碱性,另一种溶液酸性越强,越促进醋酸根水解,c(CH3COOH)浓度越大,所以c(CH3COOH)浓度关系和c(H+)关系相同:①>③>④>②,D错误。
答案:B
 例4、(福建)在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O
例4、(福建)在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是( )
HCO3-+OH-。下列说法正确的是( )
 A.稀释溶液,水解平衡常数增大
A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡向正反应方向移动
 C.升高温度,
C.升高温度,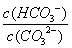 减小
减小
D.加入NaOH固体,溶液pH减小
 解析:
解析:
平衡常数仅与温度有关,故稀释时平衡常数是不变的,A错误;CO2通入水中,生成H2CO3,可以与OH-反应,平衡正向移动,B正确;升温可以促进水解,平衡正向移动,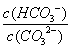 是增大的,C错误; 加入NaOH固体,碱性肯定增强,pH增大,D错误。
是增大的,C错误; 加入NaOH固体,碱性肯定增强,pH增大,D错误。
答案:B
例5、(四川卷)25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-) D.c(OH-)+c(SO42-)=c(H+)+c(NH4+)
解析:
根据电荷守恒:c(NH4+) + c(H+)=2c(SO42―) + c(OH―),所以D不正确;因溶液的pH=7,则c(H+)=c(OH―),c(NH4+)=2c(SO42―),所以A、C不正确,B正确。
答案:B
例6、(天津卷)下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
解析:
A选项由电荷守恒可知当c(H+)=c(OH-)时,C(NH4+)=C(Cl-);B选项由于Kw不变,溶液在稀释时H+浓度降低,OH-浓度必然升高;PH和体积相等的盐酸和醋酸中,醋酸的物质的量远大于盐酸,故醋酸消耗的NaOH的物质的量多;常温下Na2S和NaHS两溶液中,水解的离子方程式为:S2-+H2O HS-+OH-,HS-+H2O
HS-+OH-,HS-+H2O H2S+OH-,同浓度的Na2S和NaHS相比,Na2S比NaHS水解程度大的多,故溶液的PH也大。
H2S+OH-,同浓度的Na2S和NaHS相比,Na2S比NaHS水解程度大的多,故溶液的PH也大。
答案:D