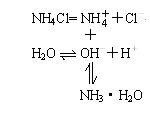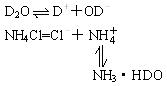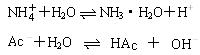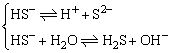| 盐类水解(强酸弱碱盐、弱酸弱碱盐、强酸强碱盐) |
主编:黄冈中学化学集体备课组
(板书)1、强碱弱酸盐——碱性(谁强显谁性)
2、强酸弱碱盐——酸性
+H2O
NH3·H2O+H+
练习:将NH4Cl固体溶于D2O中,写出反应的离子方程式。
分析:
+D2O
NH3·HDO+D+
练习:向NH4Cl溶液中加入过量的镁粉,写出反应的离子方程式。
分析:
+H2O
NH3·H2O+H+
Mg+2H+=Mg2++H2↑
NH3·H2O
NH3↑+H2O(Mg和酸的反应为放热反应)
写出下列物质水解的离子方程式:Al2(SO4)3、Cu SO4、 FeCl3。
分析:
Al3++3H2O
Al(OH)3+3H+
Cu2++2H2O
Cu(OH)2+2H+
Fe3++3H2O
Fe(OH)3+3H+
强酸弱碱盐溶液呈酸性。
(板书)3、弱酸弱碱盐——谁强显谁性
NH4Ac水解的离子方程式:
分析:
∴
+Ac-+H2O
NH3·H2O+HAc
(提问)NH4Ac溶液水解显什么性质?取决于NH3·H2O与HAc的相对强弱。酸性强,显酸性;碱性强,显碱性。前面我们学过可以用Ka、Kb来反映酸、碱的强弱,Ka越大,酸性越强;Kb越大,碱性越强。
NH4Ac+H2O
NH3·H2O+HAc
Kb=1.76×10-5,Ka=1.76×10-5
Ka=Kb,意味着NH3·H2O的碱性与HAc的酸性相当,呈中性。
Ka>Kb,呈酸性;
Ka<Kb,呈碱性。
练习:NH4CN水解的离子方程式:
+CN-+H2O
NH3·H2O+HCN,
HCN:Ka=4.93×10-10
NH4CN溶液呈碱性。
NH4Ac溶液呈中性(多元弱酸与多元强碱比第一步电离常数)。
4、强酸强碱盐——不水解,正盐溶液呈中性
NaHSO4酸式盐呈酸性
盐类水解的规律:
有弱才水解,无弱不水解,都弱都水解,
越弱越水解,谁强显谁性,同弱显中性。
思考题:NaHS、NaHSO3、NaHPO4等弱酸的酸式盐显什么性呢?
NaHS=Na++
若电离程度>水解程度,显酸性
若水解程度>电离程度,呈碱性
除NaHSO3、NaH2PO4显酸性外,其它的弱酸的酸式盐均显碱性。
练习1:
物质的量尝试相同的三种盐NaX、NaY和NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX,HZ,HY B.HX,HY,HZ
C.HZ,HY,HX D.HY,HZ,HX
答案:B。
练习2:
现有电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH
且已知:CO2+3H2O+
=2Al(OH)3↓+
当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是___________。
分析:
酸性:CH3COOH>H2CO3>
>Al(OH)3
水解程度:CH3COO-<
<
<
当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是④②①③⑤
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -