1、欲使0.1 mol·L-1NaHCO3溶液中c(H+)、c(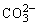 )、c(
)、c(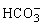 )都减小,其方法是( )
)都减小,其方法是( )
A.通入CO2 B.加入NaOH固体
C.通入HCl D.加入饱和石灰水
2、已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1 mol·L-1的NaA和NaB混合溶液中,下列排序正确的是( )
A.c(B-)>c(A-)>c(OH-)>c(H+)
B.c(OH-)>c(A-)>c(B-)>c(H+)
C.c(OH-)>c(B-)>c(A-)>c(H+)
D.c(OH-)>c(HB)>c(HA)>c(H+)
3、已知KHSO3溶液呈弱酸性。在0.1 mol·L-1KHSO3溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(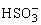 )+c(OH-)+c(
)+c(OH-)+c(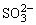 )
)
B.c(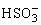 )+c (
)+c ( )=0.1 mol·L-1
)=0.1 mol·L-1
c.c(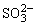 )<c (H2SO4)
)<c (H2SO4)
D.c(K+)=c(H2SO3)+c(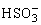 )+c(
)+c(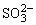 )
)
4、某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11能NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(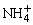 )之和
)之和
5、25℃时,在20 mL 0.1000 mol·L-1NaOH溶液中逐滴加入0.2000 mol·L-1醋酸溶液,其pH变化曲线如图所示,有关粒子浓度关系的比较中正确的是( )
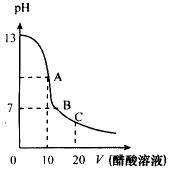
A.在A点:c (Na+)> c (OH-)> c (CH3COO-)> c (H+)
B.在A点:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
C.在B点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
6、物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2SO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、CH3COOH、C2H5OH、HCl
7、欲使0.1 mol·L-1 CH3COONa溶液中,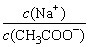 更接近于1∶1,应采取的措施是( )
更接近于1∶1,应采取的措施是( )
①加入NaOH固体 ②加入适量CH3COOH ③加入KOH固体 ④加水稀释
A.②③ B.①④
C.②③④ D.①②③
8、25℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )
A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(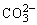 )均增大
)均增大
9、用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水.滴定过程中不可能出现的结果是( )
A.c(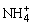 )>c(Cl),c(OH-)>c(H+)
)>c(Cl),c(OH-)>c(H+)
B.c(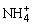 )=c(Cl-),c(OH-)=c(H+)
)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(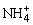 ),c(OH-)>c(H+)
),c(OH-)>c(H+)
D.c(Cl-)>c(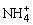 ),c(H+)>c(OH-)
),c(H+)>c(OH-)
10、下列各溶液中,微粒的物质的量浓度关系正确的是( )
A.10 mL 0.5 mol·L-1 CH3COONa溶液与6 mL1 mol·L-1盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol·L-1 pH=4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4,④NH3·H2O;c(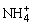 )由大到小的顺序是①>②>③>④
)由大到小的顺序是①>②>③>④
11、常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
则:①B是_________溶液,C是_________溶液。
②常温下若B溶液中c(OH-)与C溶液中c(H+)相同,B溶液的pH用pHb表示,C溶液的pH用pHc表示,则pHb+pHc=_________(填某个数)。
12、(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”、“碱性”或“中性”),溶液中c(Na+)_________c(CH3COO-)(填“>”、“<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈_________ (填“酸性”、“碱性”或“中性”),溶液中c(Na+) _________c(CH3COO-)(填“>”、“<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_________ (填“酸性”、“碱性”或“中性”),醋酸溶液的体积_________氢氧化钠溶液的体积(填“>”、“<”或“=”)。
(4)将m mol·L-1的醋酸和n mol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_________氢氧化钠溶液中c(OH-)(填“>”、“<”或“=”),m与n的大小关系是m_________n(填“>”、“<”或“=”)。
13、已知溶液中只存在OH-、H+、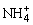 、Cl-四种离子,试回答下列问题:
、Cl-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质。则该溶质是_________,上述四种离子浓度由大到小的排列顺序是_________。
(2)若溶液中c(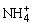 )>c(Cl-)>c(OH-)>c(H+),则该溶液中的溶质为_________。若溶液中c(Cl-)>c(H+)>c(
)>c(Cl-)>c(OH-)>c(H+),则该溶液中的溶质为_________。若溶液中c(Cl-)>c(H+)>c(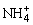 )>c(OH-),则该溶液中的溶质为_________。
)>c(OH-),则该溶液中的溶质为_________。
(3)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl) _________c(NH3·H2O)(填“>”、“<”或“=”,下同),混合前酸中c(H+)和碱中c(OH-)的关系c(H+)_________c(OH-)。
14、常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验偏号 |
HA物质的量浓度
(mol·L-1) |
NaOH物质的量浓度
(mol·L-1) |
混合溶液的pH |
① |
0.1 |
0.1 |
pH=9 |
② |
c |
0.2 |
pH=7 |
③ |
0.2 |
0.1 |
pH<7 |
(1)从①组情况分析.HA是强酸还是弱酸? _________(填“强酸”或“弱酸”)。
(2)②组情况表明,c_________0.2 mol·L-1(选填“大于”、“小于”或“等于”)。混合液中c(A-)与c(Na+)的大小关系是_________。
(3)从③组实验结果分析,说明HA的电离程度_________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合液中离子浓度由大到小的顺序是__________________。
(4)①组实验所得混合液中由水电离出的c(OH-)=_________mol·L-1。写出该混合液中下列算式的精确结果(不能作近似计算)。c(Na+)-c(A-)=_________ mol·L-1,c(OH-)-c(HA)= _________mol·L-1。