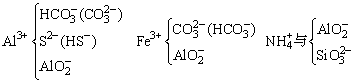| 影响盐类水解的因素及其应用 |
主编:黄冈中学化学集体备课组
一、影响盐类水解的因素
1、盐类的水解平衡
盐类水解反应程度微弱,一般是可逆反应,在一定条件下达到平衡时,该化学平衡叫水解平衡。
例:CH3COONa+H2O
CH3COOH+NaOH
(讲)正反应为CH3COONa的水解,逆反应为CH3COOH和NaOH的中和反应,达到平衡时v水解=v中和。
在稀溶液中参加反应的水分子比率很小,c(H2O)可视为常数,则K·c(H2O)仍为常数,设为Kh,有Kh= K·c(H2O),盐的水解常数,Kh越大,水解程度越大。
(讲)根据化学平衡中的勒夏特列原理,当外界条件改变时,水解平衡被破坏。
2、影响盐类水解的因素
(1)内因:盐的本性
(讲)盐水解程度的大小,主要由盐电离出来的弱酸根离子或弱碱离子的水解的难易程度决定的。弱酸根离子对应的弱酸酸性越弱,该弱酸根离子越易水解;弱碱根离子对应的弱碱碱性越弱,该弱碱根离子越易水解。
举例:pH值:Na2CO3>NaHCO3>NaAc。
(2)外因:
①温度:升高温度,促进盐的水解。
②浓度:浓度越小,盐的水解程度越大。
③溶液的酸碱性:促进或抑制盐的水解。
影响FeCl3水解的因素:
Fe3++3H2O
Fe(OH)3+3H+
条件
平衡移动方向
H+数目
pH
现象
加热
正向
↑
↓
颜色变深
加水
正向
↑
↑
颜色变浅
加FeCl3(s)
正向
↑
↓
颜色变深
加Fe
逆向
↓
↑
颜色变浅
加少量浓H2SO4
逆向
↑
↓
颜色变浅
二、盐类水解的应用
1、泡沫灭火剂
泡沫灭火器:一遇火警,将灭火器倒置,而产生大量CO2气体,为什么能产生CO2气体?
倒置前:Al3++3H2O
Al(OH)3+3H+
+H2O
H2CO3+OH-
倒置后:Al3++
=Al(OH)3↓+3CO2↑
双水解反应:当弱酸的酸根与弱碱的阳离子同时存在于水溶液中时,弱酸的酸根水解生成的氢氧根离子与弱碱的阳离子水解生成的氢离子反应生成水,而使两种离子的水解平衡向水解方向移动,互相促进水解,而水解完全。
常见的完全双水解离子组:
双水解反应一般趋于完成,用“=”不用“
”,难溶物质沉淀要加“↓”符号,气体要加“↑”符号。
2、某些盐的配制及贮存
配制Al2(SO4)3溶液时,为了防止发生水解,可以加入少量的H2SO4;
配制Na2S溶液时为了防止水解,可以加入少量的NaOH。
配制FeSO4溶液时,可以加入Fe和稀H2SO4,使所配溶液更澄清更纯。
贮存Na2SiO3、NaClO溶液时应配橡皮塞,不能配磨口玻璃塞。
3、某些盐溶液的蒸干与制备某些无水盐
FeCl3和Fe2(SO4)3溶液加热蒸干灼烧后,所得到的固体为Fe2O3和Fe2(SO4)3。
FeCl3+3H2O
Fe(OH)3+3HCl
2Fe(OH)3
Fe2O3+3H2O
Fe2(SO4)3+6H2O
Fe(OH)3+3H2SO4(难挥发性酸)
思考:如何由FeCl3(aq)→FeCl3(s)?
加热过程中持续通入HCl气体,抑制其水解,即在HCl气流中加热浓缩FeCl3(aq)。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -