盐的水解常数
1、盐的水解常数
(1)弱酸强碱盐的水解。以CH3COONa为例:
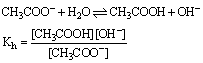
Kh称为水解常数。
在这个水溶液中,除了 CH3COO-离子的水解平衡外,还有下面两个平衡关系同时存在:
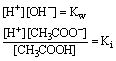
这两个平衡关系式相除,即得 CH3COO-离子的水解平衡式:
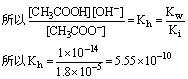
由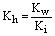 可知水解产生的弱电解质的电离常数越小,则水解程度越大。
可知水解产生的弱电解质的电离常数越小,则水解程度越大。
对于弱酸强碱盐来说,其水解常数表示为: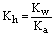
Ka表示水解产生的弱酸的电离常数。
(2)弱碱强酸盐的水解
用上述同样方法,也可导出弱碱强酸盐的水解常数: ,Kb为水解产生的弱碱的电离常数。
,Kb为水解产生的弱碱的电离常数。
(3)弱酸弱碱盐的水解。以CH3COONH4为例:
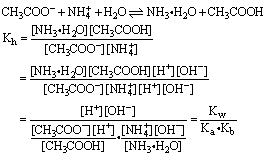
式中 Ka和Kb分别代表水解产物弱酸和弱碱的电离常数。
由上述三个关系说明,盐水解后生成的弱酸、弱碱的电离平衡常数越大,则盐的水解常数越小。另外,盐的水解一般都是吸热过程,所以,当温度升高时水解常数 Kh增大。温度不变,水解常数Kh也不变。Kh不受浓度的影响。