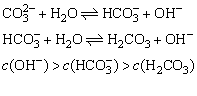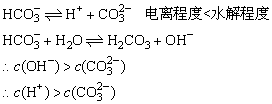| 盐溶液中离子浓度的大小的判断 |
主编:黄冈中学化学集体备课组
(讲)由于某些离子水解,导致某些盐溶液中的离子种类增多,分析溶液中离子浓度的大小关系,可以利用电荷守恒、原子守恒以及水电离产生的H+守恒。
例1、在0.1 mol·L-1的Na2CO3溶液中,下列关系式错误的是( )
A.c(Na+)+c(H+)=2c(
)+c(
)+c(OH-)
B.c(Na+)=2c(
)+2c(H2CO3)+2c(
)
C.c(OH-)=c(H+)+c(
)+2c(H2CO3)
D.c(Na+)>c(
)>c(
)>c(H+)>c(OH-)
E.c(Na+)>c(
)>c(OH-)>c(
)>c(H2CO3)
解析:
(1)电荷守恒,即溶液中所有阳离子所带的正电荷等于所有阴离子所带的负电荷。
如:c(Na+)+c(H+)=c(
)+c(OH-)+2c(
)。
(2)原子守恒(物料守恒、质量守恒),指某些特征性的原子是守恒的。如Na2CO3溶液中无论C以什么形式存在,总有n(Na)=2n(C),故:
c(Na+)=2c(
)+2c(
)+2c(H2CO3)。
(3)水电离出来的H+守恒(质子守恒),是依据水电离出来的H+与OH-的物质的量前是相等的。故:c(OH-)=c(H+)+c(
)+2c(H2CO3)。
答案:D。
例2、在K2S溶液中,各微粒的浓度关系正确的是( )
A.c(OH-)=c(H2S)+c(HS-)+c(H+)
B.c(K+)=2c(H2S)+2c(HS-)+2c(S2-)
C.c(K+)+c(H+)=c(HS-)+c(S2-)+c(OH-)
D.c(K+)+c(OH-)=4c(H2S)+3c(HS-)+2c(S2-)+c(H+)
答案:B D。
(板书有误:此处视频中将答案误写成了AD,应该是BD。)
例3、0.02mol·L-1的HCN溶液与0.02mol·L-1的NaCN溶液等体积混合,已知混合液中c(CN-)<(Na+),则下列关系正确的是( )
A.c(Na+)>c(CN-)>c(OH-)>c(H+)
B.c(HCN)+c(CN-)=0.04mol·L-1
C.c(Na+)+c(H+)=c(CN-)+c(OH-)
D.c(CN-)>c(HCN)
解析:
0.01mol·L-1HCN与0.01mol·L-1NaCN
HCN
H++CN-
CN-+H2O
NCN+OH-
根据电荷守恒:c(Na+)+c(H+)=c(CN-)+c(OH-)
c(CN-)<c(Na+)
∴c(OH-)>c(H+)
溶液呈碱性,CN-的水解程度高,大于HCN的电离很高
∴c(HCN)>c(CN-)
且c(HCN)>0.01mol·L-1,c(CN-)<0.01mol·L-1,c(HCN)+c(CN-)=0.02mol·L-1
答案:AC。
例4、下列溶液中,离子浓度大小的排列顺序错误的是( )
A.0.1mol·L-1 NH4Cl溶液中:c(Cl-)>c(
)>c(H+) >c(OH-)
B.0.1mol·L-1 NaHCO3溶液中:c(Na+)>c(
)>c(OH-)>c(H+)>c(
)
C.pH=2盐酸与pH =12氨水等体积混合:c(Cl-)>c(
)>c(H+)>c(OH-)
D.0.2mol·L-1 CH3COONa与0.1mol·L-1 HCl等体积混合,呈酸性:
c(
)>c(Cl-)>c(CH3COOH)>c(H+)
解析:
A项: c(
)+c(H+) =c(OH-)+ c(Cl-)
因为c(H+) >c(OH-),所以c(
)< c(Cl-),
所以c(Cl-)>c(
)>c(H+) >c(OH-)。
B项:
C项:
NH4Cl与大量的氨水混合,溶液显碱性,
所以c(
)>c(Cl-)>c(OH-)>c(H+)。
D项:
0.05mol·L-1 CH3COONa、0.05mol·L-1 CH3COOH与0.05mol·L-1 NaCl混合,CH3COOH的电离占主导地位,溶液显酸性。
CH3COO-+H2O
CH3COOH+OH-
CH3COOH
CH3COO-+H+
所以c(CH3COO-)>c(Cl-)>c(H+)>c(OH-)。
答案:C。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -