1、下列说法正确的是( )
A.硫酸钡放入水中不导电,则硫酸钡是非电解质
B.物质溶于水达到饱和时,溶解过程就停止了
C.绝对不溶解的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中浓度为0
2、把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)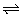 Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
Ca2+(aq)+2OH-(aq)。下列说法正确的是( )
A.恒温下向溶液中加入CaO,溶液pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
3、在BaSO4饱和溶液中,加入Na2SO4(s),达平衡时( )
A.c(Ba2+)=c(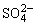 )
)
B.c(Ba2+)=c( )=[Ksp(BaSO4)]+
)=[Ksp(BaSO4)]+
C.c(Ba2+)≠c(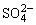 ),c(Ba2+)·c (
),c(Ba2+)·c (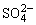 )=Ksp(BaSO4)
)=Ksp(BaSO4)
D.c(Ba2+)≠c(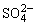 ),c(Ba2+)·c (
),c(Ba2+)·c ( )≠Ksp(BaSO4)
)≠Ksp(BaSO4)
4、已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10(mol·L-1)。现向1 L 0.2 mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中正确的是( )
A.25℃时,0.1mol·L-1HF溶液中pH=1
B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中没有沉淀生成
D.该体系中HF与CaCl2反应产生沉淀
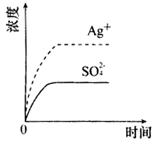
5、已知Ag2SO4的Ksp为2.0×10-5,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和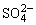 浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和
浓度随时间变化关系如图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol·L-1Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和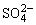 浓度随时间变化关系的是( )
浓度随时间变化关系的是( )
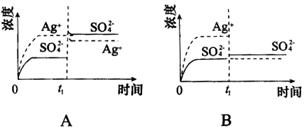
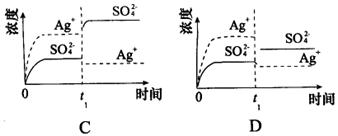
6、下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
7、类似于水的离子积,难溶盐AmBn也有离子积Ksp=[c(An+)]m·[c(Bm-)]n,已知常温下BaSO4的溶解度为2.33×10-4g,则其Ksp为( )
A.2.33×10-4(mol·L-1)2
B.1×10-5(mol·L-1)2
C.1×10-10(mol·L-1)2
D.1×10-12(mol·L-1)2
8、在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,下列说法正确的是( )
A.AgCl沉淀溶解平衡正向移动
B.AgCl溶解度增大
C.溶液中c(Ag+)增大
D.溶液中c(Cl-)增大
9、在一定温度下,氯化银饱和溶液中c(Ag+)·c(Cl-)=Ksp。现将足量的AgCl分别加入到下列各种物质中,AgCl的溶解度由大到小排列顺序正确的是( )
①20 mL0.01 mol·L-1KCl(aq) ②30 mL0.02 mol·L-1CaCl2(aq) ③40 mL 0.03mol·L-1HCl(aq) ④10 mL蒸馏水 ⑤50 mL 0.05 mol·L-1AgNO3(aq)
A.①>②>③>④>⑤ B.④>①>③>②>⑤
C.⑤>④>②>①>③ D.④>③>⑤>②>①
10、已知:25℃时,KSP[Mg(OH)2]=5.61×10-12(mol·L-1)3,Ksp[MgF2]=7.42×10-11(mol·L-1)3。下列说法正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的KSP比在20 mL0.01 mol·L-1 NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
12、医学上在进行肠胃疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。
Ⅰ.请写出BaSO4能作为钡餐透视的另一个理由____________________。
Ⅱ.请用文字叙述和离子方程式说明钡餐透视为什么不用BaCO3?
______________________________________________________________________
Ⅲ.某课外活动小组为探究BaSO4的溶解度,分别将足量BaSO4放入:
①5 mL水
②20 mL 0.5 mol·L-1的Na2SO4溶液
③40 mL0.4 mol·L-1的Ba(OH)2溶液
④40 mL 0.2 mol·L-1的H2SO4溶液,溶解至饱和。
(1)以上各溶液中,c(Ba2+)的大小顺序正确的是__________(填序号)。
A.③>①>④>② B.③>①>②>④
C.①>④>③>② D.①>③>④>②
(2)已知25℃时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液③中的c(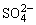 )为__________,溶液②中c(Ba2+)为__________。
)为__________,溶液②中c(Ba2+)为__________。
(3)某同学取同样的溶液③和溶液④直接混合,则混合溶液的pH为__________ (假设混合后溶液的体积为混合前两溶液的体积之和)。
13、已知:Cu(OH)2 Cu2+(aq)+2OH- (aq),Ksp=c(Cu2+)·[c(OH-)]2=2×10-20(mol·L-1)3。
Cu2+(aq)+2OH- (aq),Ksp=c(Cu2+)·[c(OH-)]2=2×10-20(mol·L-1)3。
(1)某溶液中c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液的pH大于__________。
(2)要使0.2 mol·L-1CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液pH等于__________。
14、已知常温下,FeS的Ksp=6.25×10-18(mol·L-1)2,ZnS的Ksp=1.2×10-23(mol·L-1)2,H2S的饱和溶液中[c(H+)]2·c(S2-)=1.0×10-22。试回答下列问题:
(1)向ZnS的饱和溶液中:①加入少量固体Na2S,则溶液中c(S2-)__________ (填“变大”、“变小”或“不变”,下同);②加入ZnS固体,则溶液中c(S2-)__________;③加入FeS固体,则溶液中c(Zn2+)__________。
(2)在常温下,将适量的FeS投入到氢硫酸饱和溶液中,欲使溶液中c(Fe2+)达到1 mol·L-1,应调节pH=__________ (已知lg2=0.3)