例1、(重庆)下列热化学方程式正确的是(△H的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)=SO2(g);△H=-269.8kJ/mol(反应热)
D.2NO2=O2+2NO;△H=+116.2kJ/mol(反应热)
解析:
A项燃烧热要求可燃物的物质的量必须为1mol,得到的氧化物必须是稳定的氧化物,H2O的状态必须为液态,A项错误;中和反应是放热反应,△H应小于0,B项错误;热化学反应方程式要注明物质在反应时的状态,D项错误。
答案:C
例2、(天津卷)已知:2CO(g)+O2(g)=2CO2(g);△H=-566kJ/mol  Na2O2(s)+CO2(g)=Na2CO3(s)+
Na2O2(s)+CO2(g)=Na2CO3(s)+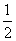 O2(g);ΔH=-226kJ/mol
O2(g);ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
 A.CO的燃烧热为283kJ
A.CO的燃烧热为283kJ
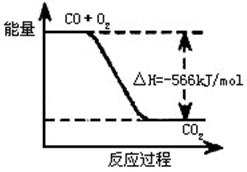
 B.下图可表示由CO生成CO2的反应过程和能量关系
B.下图可表示由CO生成CO2的反应过程和能量关系
 C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);ΔH>-452kJ/mol
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g);ΔH>-452kJ/mol
 D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
解析:
A选项单位错误,应为kJ/mol;B选项中的图像应该表示2mol CO与1mol O2反应的放热;C选项,要注意CO2为固态,那么它气化时要吸收热量,因此放热小于452kJ/mol,但ΔH为负值,因此,ΔH>-452kJ/mol;D选项可以将已知的两个方程式叠加,去掉氧气,得到:Na2O2(s)+CO(g)=Na2CO3(s);ΔH=-509kJ/mol。因此可知放出509kJ热量时,电子转移2mol,数目为2×6.02×1023。
答案:C