| 燃烧热 中和热 能源 |
主编:黄冈中学化学集体备课组
(引)由于反应的情况不同,反应热可分为多种,如燃烧热、中和热等,我们先复习中和热。
一、中和热
1、稀溶液中,酸和碱发生中和反应生成1mol H2O时的反应热叫做中和热。
单位:kJ·mol-1
2、中和热的表示:
NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1
NaOH(aq)+
H2SO4(aq)=
Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
以生成1mol H2O为标准配平其它物质的化学计量数。
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ·mol-1
若用弱酸与弱碱代替强酸,因为弱酸和弱碱的电离吸热,所测的中和热的数值小于57.3kJ·mol-1。
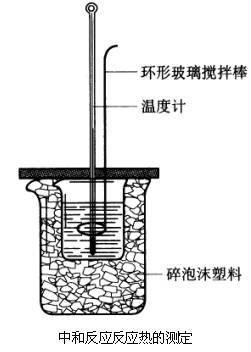
3、中和热的测定
实践活动
中和反应反应热的测定
实验目的
测定强酸与强碱反应的反应热,体验化学反应的热效应。
实验用品
大烧杯(500mL)、小烧杯(100mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
0.50 mol/ L盐酸、0.55 mol/L NaOH溶液①。
实验步骤
1、在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,以达到保温、隔热、减少实验过程中热量损失的目的,如图所示。该实验也可在保温杯中进行。
2、用一个量筒量取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
3、用另一个量筒量取50 mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
4、把套有盖板的温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面),盖好盖板。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
重复实验步骤2~4三次。
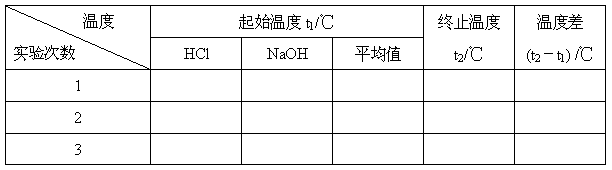
实验数据处理
1、取三次测量所得数据的平均值作为计算依据.
t1/℃
t2/℃
(t2-t1) /℃
2、计算反应热
为了计算简便,我们近似地认为实验所用酸、碱溶液的密度和比热容与水相同,并忽略实验装置的比热容,则:
(1)50 mL0.50 mol/L盐酸的质量m1=50 g,50 mL 0.55 mol/L NaOH溶液的质量m2=50g。
(2)中和后生成的溶液的比热容c=4.18J(g·℃),50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液发生中和反应时放出的热量为:
(m1+m2)·c·(t2-t1)=0.418(t2-t1)kJ
生成1mol H2O时的反应热为:
注:①为了保证0.50 mol/L的盐酸完全被NaOH中和,采用0.55 mol/L NaOH溶液,使碱稍稍过量。
二、燃烧热
1、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。单位:kJ·mol-1
2、表示的意义:C的燃烧热为393.5kJ·mol-1,表示在101kPa时,1mol C完全燃烧放出393.5kJ的热量。
3、注意:
①可燃物的物质的量为1mol。
如:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
H2(g)+
O2(g)=H2O(l) △H=-285.8kJ·mol-1
则H2的燃烧热为285.8kJ·mol-1,2mol H2生成2mol液态水时的反应热为-571.6kJ·mol-1。
Q放=n(可燃物)×△HC (△HC:可燃物的燃烧热)。
②可燃物必须完全燃烧,生成稳定的氧化物。
若生成不稳定的氧化物,所放出的热量不是燃烧热,如:C(s)+
O2(g)=CO(g)
△H=-195.4kJ·mol-1,因CO可继续燃烧生成CO2并放出热量。
如:C(s)→CO2(g),H2(g)→H2O(l),S(s)→SO2(g)(而非SO3)。
③书写燃烧热的热化学方程式时,应以燃烧1mol物质为标准来配平其余物质的化学计量数。
练习:
乙烷的燃烧热为1559.8kJ·mol-1,书写乙烷的燃烧热化学方程式:
C2H6(g)+
O2(g)=2CO2(g)+3H2O(l) △H=-1559.8kJ·mol-1
例:在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=+725.8kJ·mol-1
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452kJ·mol-1
C.CH3OH(l)+
O2(g)=CO2(g)+2H2O(g) △H=-725.8kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=+1452kJ·mol-1
答案:B
三、中和热、反应热、燃烧热的关系
四、能源
2、我国主要能源:化石燃料。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班