1、下列有关燃料燃烧的说法正确的是( )
A.使燃料充分燃烧空气量越多越好
B.物质燃烧都需要氧气
C.水煤气不属于化石燃料,而煤、石油、天然气属于化石燃料
D.液化气是目前世界上最重要的气体矿物燃料
2、天然气的主要成分CH4是一种产生温室效应的气体。等物质的量的CH4和CO2产生的温室效应前者大。下面有关天然气的叙述正确的是( )
①天然气与煤、柴油相比是较清洁的能源 ②等质量的CH4和CO2产生的温室效应也是前者大 ③燃烧天然气也是酸雨的形成原因之一
A.①②③ B.①
C.①② D.③
3、1.5g火箭燃料二甲基肼(CH3—NH—NH—CH3)完全燃烧,放出50kJ热量,则二甲基肼的燃烧热为( )
A.1000kJ/mol B.1500kJ/mol
C.2000kJ/mol D.3000kJ/mol
4、下列关于中和热的说法不正确的是( )
A.发生酸碱中和反应时所放出的热量叫中和热
B.中和反应的实质是H+与OH-结合生成水,若有其他物质生成,这部分反应热不在中和热内
C.在稀溶液中,强酸跟强碱发生中和反应生成1mol水时所放出的热量称为中和热
D.中和热不包括物质溶解、电离、水合等过程中的热效应
5、燃烧一定量丁烷气体放出的热量为x Q,完全吸收它生成的CO2生成正盐,需5mol·L-1的KOH溶液100mL,则丁烷的燃烧热为( )
A.16xQ B.8xQ
C.4xQ D.2xQ
6、25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+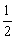 O2(g)=CO(g)
O2(g)=CO(g)
△H=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(g)
△H=+571.6kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)
△H=-890.3kJ/mol
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)
△H=-1400kJ/mol
7、天然气、石油、煤等在地球上的蕴藏量是有限的,因此,①可利用电解水的方法得到H2作能源;②可用酒精作能源;③砍伐树木作能源;④应开发太阳能、核能等新的能源。上述说法正确的是( )
A.只有① B.②和④
C.②和③ D.只有④
8、在100g碳不完全燃烧所得气体中,CO占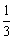 体积,CO2占
体积,CO2占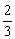 体积。
体积。
C(s)+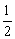 O2(g)=CO(g) △H=-110.35kJ/mol
O2(g)=CO(g) △H=-110.35kJ/mol
CO(g)+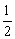 O2(g)=CO2(g) △H=-282.57kJ/mol
O2(g)=CO2(g) △H=-282.57kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
A.392.92kJ B.2489.44kJ
C.784.92kJ D.3274.3kJ
9、燃烧10g乙烷气体生成液态水,共放出519.6kJ热量,则乙烷的燃烧热为( )
A.-3117.6kJ/mol B.3117.6kJ/mol
C.1558.8kJ/mol D.-1558.8kJ/mol
10、根据以下叙述,回答:
能源可划分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:
2H2O(l)=2H2(g)+O2(g)
△H=+571.6kJ/mol
(1)下列叙述正确的是( )
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.焦炉气是一级能源
(2)已知:CH4(g)+2O2(g)=2H2O(l)+CO2(g)△H=-890.3kJ/mol,1g H2和1g CH4分别燃烧后,放出的热量之比约是( )
A.1∶3.4 B.1∶1.7
C.2.57∶1 D.4.6∶1
(3)关于用水制取二级能源H2,以下研究方向正确的是( )
A.构成水的氢和氧都是可以燃烧的物质,因此,可研究在水不分解的情况下,使氢成为二级能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
11、某种发动机燃料由A、B两种物质混合而成,且A、B两种物质均含有C、H、O三种元素中的两种或三种。已知常温下A、B的燃烧热如下:
物质 |
A |
B |
燃烧热/(kJ/mol) |
-725 |
-5518 |
(1)1mol由A、B等物质的量混合而成的燃料,在足量的氧气中燃烧放出的热量为__________kJ。
(2)A、B以不同比例混合的燃料91.2g在足量的氧气中燃烧时,放出的热量Q与混合燃料中B的物质的量分数x的关系如图所示。
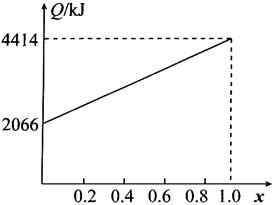
①相对分子质量:A为__________;B为__________。
②若A为醇,B为烷烃,则A的分子式为__________,B的分子式为__________。
12、目前大部分城市居民所使用的燃料主要是管道煤气,使用天然气作为民用燃料对环境更为有利。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
2CO+O2 2CO2;2H2+O2
2CO2;2H2+O2 2H2O;CH4+2O2
2H2O;CH4+2O2 CO2+2H2O。
CO2+2H2O。
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是__________。因此,燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是__________进风口(填“增大”或“减小”),如不作改进,可能产生的不良结果是____________________。管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
|
乙烷 |
丙烷 |
丁烷 |
熔点(℃) |
-183.3 |
-189.7 |
-138.4 |
沸点(℃) |
-88.6 |
-42.1 |
-0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是______________________________。
13、城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是一氧化碳和氢气的混合气,它由煤炭与水(蒸气)反应制得,故又称水煤气。
(1)试写出制取煤气的主要化学反应方程式:____________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220.0kJ/mol。已知CO气体燃烧的热化学方程式为:CO(g)+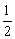 O2(g)=CO2(g)△H=-282.57kJ/mol。试比较燃烧同物质的量的C3H8和CO,产生热量的比值约为__________。
O2(g)=CO2(g)△H=-282.57kJ/mol。试比较燃烧同物质的量的C3H8和CO,产生热量的比值约为__________。
(3)已知氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol。试比较燃烧同质量的氢气和丙烷,产生的热量比值约为__________。
14、在火箭推进器中装有还原剂肼(N2H4)和强氧化剂H2O2,当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热。已知0.4mol液态肼和足量H2O2反应生成氮气和水蒸气时放出256.64kJ的热量。
(1)写出肼和H2O2反应的热化学方程式____________________。
(2)上述反应应用于火箭推进器,除释放出大量热量和快速产生大量气体外,还有一个很突出的优点是____________________。
(3)用氨和次氯酸钠按一定的物质的量之比混合、可生成肼,写出反应的化学方程式____________________,该反应的还原产物是__________。