例1、(广东)可用于电动汽车的铝-空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是( )
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-=Al(OH)3↓
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
解析:
电解液无论是NaOH,还是NaCl,在正极上都是O2得到电子被还原,A正确;生成的Al(OH)3是两性氢氧化物,在碱溶液中发生反应生成AlO2-,B错误;生成的Al(OH)3与NaOH反应生成NaAlO2,消耗电解质中的NaOH,使pH减少,C错误;原电池中,电子在外电路的负极流向正极,D错误。
答案:A
例2、(福建)控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
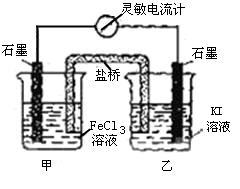
 A.反应开始时,乙中石墨电极上发生氧化反应
A.反应开始时,乙中石墨电极上发生氧化反应
 B.反应开始时,甲中石墨电极上Fe3+被还原
B.反应开始时,甲中石墨电极上Fe3+被还原
 C.电流计读数为零时,反应达到化学平衡状态
C.电流计读数为零时,反应达到化学平衡状态
 D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
 解析:
解析:
乙中I-失去电子放电,发生氧化反应,A正确;由总反应方程式知,Fe3+被还原成Fe2+,B正确;当电流计为零时,说明没有电子发生转移,反应达到平衡,C正确。加入 Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,甲中石墨电极为负极,D错误。
Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,甲中石墨电极为负极,D错误。
答案:D
例3、(浙江)市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2 2Li0.85NiO2。下列说法不正确的是( )
2Li0.85NiO2。下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-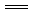 Li+
Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
解析:
放电时,负极反应:Li-e- Li+;正极反应:2Li0.35NiO2+e-+Li+
Li+;正极反应:2Li0.35NiO2+e-+Li+ 2Li0.85NiO2
2Li0.85NiO2
,Li+向正极移动,所以D错误,Li很活泼,会与水反应,不能用水溶液。B中充电时,Li0.85NiO2的Ni的氧化数由3.15升高到3.65,被氧化,部分Li+还原为Li。
答案:D
例4、(全国理综II)在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
解析:
本题考查的是原电池的有关知识。氢离子移向正极,在铜片上放电,所以A、C错;锌片是负极,输出电子,所以B错。
答案:D
例5、(广东卷)科学家近年来研制出一种新型细菌燃料电池,利用细菌将有机酸转化为氢气,氢气进入以磷酸为电解质的燃料电池发电。电池负极反应为( )
A.H2+2OH-=2H2O+2e- B.O2+4H++4e-=2H2O
C.H2=2H++2e- D.O2+2H2O+4e-=4OH-
解析:
本题以新科技为背景,考查氢燃料电池的电极反应方程式的书写。原电池发生的反应为氧化反应,在氢氧燃料电池中,负极通入氢气,正极通入氧气,因电解质溶液为磷酸,故其反应方程式为:H2-2e-=2H+或H2=2H++2e-。电解液为酸性,故A错,负极通入氢气,正极通入氧气,故B、D错。
答案:C
例6、(上海卷)将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
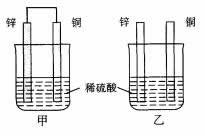
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
解析:
图甲是一个原电池装置,负极(Zn):Zn-2e-=Zn2+,正极(Cu):2H++ 2e-=H2↑,形成原电池能加快产生氢气的速度;图乙中,Zn直接与稀H2SO4反应生成H2:Zn + 2H+=Zn2++H2↑,甲、乙两烧杯中H2SO4均被消耗,溶液的pH均增大。可见只有选项C正确。
答案:C