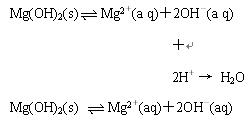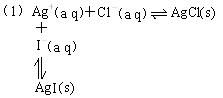| 沉淀反应的应用 |
主编:黄冈中学化学集体备课组
(讲)难溶电解质的溶解平衡也是动态平衡,可以通过改变条件使平衡移动,使溶液中的离子转化为沉淀或沉淀转化为溶液中的离子。
1、沉淀的生成
(讲)在涉及无机制备,提纯工艺的生产、科研、废水处理等领域,常利用生成沉淀来达到分离和除去某些离子的目的。
①NH4Cl(FeCl3)
Fe(OH)3↓,调节pH使氢氧化物沉淀。
②转化为极难溶的硫化物沉淀。
如:Cu2+、Hg2+
CuS↓、HgS↓
思考与交流:
利用生成沉淀分离或除去某种离子,首先要使生成沉淀的反应能够发生;其次希望沉淀生成的反应进行得越完全越好。
1、如果要除去某溶液中
,你选择加入钙盐还是钡盐?为什么?
2、以你现有的知识,你认为判断沉淀能否生成可从哪些方面考虑?是否可能使要除去的离子全部通过沉淀除去?说明原因。
几种难溶电解质的溶度积(25℃)
化学式 |
溶度积 |
化学式 |
溶度积 |
AgCl |
1.8×10-10 |
CuS |
6.3×10-36 |
Ag2SO4 |
1.4×10-5 |
Cu(OH)2 |
2.2×10-20 |
Ag2S |
6.3×10-50 |
Fe(OH)2 |
8.0×10-16 |
BaSO4 |
1.1×10-10 |
Fe(OH)3 |
4.0×10-38 |
CaCO3 |
2.8×10-9 |
MgCO3 |
6.8×10-6 |
CaSO4 |
9.1×10-6 |
Mg(OH)2 |
1.8×10-11 |
2、沉淀的溶解
(演示实验)向3支盛有少量Mg(OH)2沉淀的试管中分别滴加适量的蒸馏水、盐酸和NH4Cl溶液。
思考与交流:
水解呈酸性,使OH-与H+反应?还是
与OH-生成NH3·H2O,使得平衡的溶解方向移动?
补充实验:Mg(OH)2与NH4Ac溶液反应,Mg(OH)2溶解,主要还是
与OH-生成NH3·H2O。
使沉淀溶解的规律:设法从沉淀溶解平衡体系中不断移去溶解电离出的离子,如生成气体、生成弱电解质(NH3·H2O)等,促使沉淀溶解平衡向溶解的方向移动。
①加入酸溶液:Mg(OH)2+2HCl=MgCl2+2H2O
②加入盐溶液:Mg(OH)2+2NH4Cl=MgCl2+2NH3·H2O
3、沉淀的转化
实验1:
向盛有10滴0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L NaCl溶液,至不再有白色沉淀生成。向其中滴加0.1 mol/L KI溶液,观察、记录现象;再向其中滴加0.1 mol/L的Na2S溶液,观察并记录现象。
步骤 |
NaCl和AgNO3 溶液混合 |
向所得固液混合物 中滴加KI溶液 |
向新固液混合物中 滴加Na2S溶液 |
现象 |
|
|
|
实验2:
向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加1~2滴2 mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1 mol/L FeCl3溶液,静置。观察并记录现象。
步骤 |
向MgCl2溶液中滴加 NaOH溶液 |
向有白色沉淀的溶液中 滴加FeCl3溶液 |
静置 |
现象 |
|
|
|
思考与交流:
(讲)AgCl白色沉淀与溶液中的Ag+、Cl-建立了溶解平衡,当加入KI溶液时,Ag+与I-离子生成黄色沉淀AgI,此时AgI与溶液中的Ag+与I-又将建立新的沉淀溶解平衡,由于AgI的Ksp小于AgCl的Ksp,AgI沉淀的生成破坏了AgCl的沉淀溶解平衡,由于Ag+浓度的降低,使得AgCl的平衡不断逆向移动,AgCl不断溶解,AgI不断生成。
同理AgI转化为Ag2S也是一样的道理,由于Ag2S比AgI更难溶。
Mg(OH)2转化为Fe(OH)3,Fe(OH)3比Mg(OH)2更难溶。
(2)颠倒操作步骤,转化不会发生。
(板书)
结论:一种沉淀可以转化成另一种更难溶的沉淀,难溶物的溶解度差别越大,这种转化的趋势越大。
实质:沉淀溶解平衡的移动。
解释:水垢的成分是CaCO3和Mg(OH)2,而不是MgCO3。
(讲)对于一些用酸或其它方法也不能溶解的沉淀,可将其转化为另外一种用酸或其它方法能溶解的沉淀。
氟化物防治龋齿的化学原理:
20世纪50年代初,流行病学研究发现氟化物具有阻止龋齿发生的作用。1955年,添加氟化亚锡(SnF2)的牙膏问世。后来,一氟磷酸钠(Na2PO3F)代替了氟化亚锡,成为世界上防龋研究中最广泛应用的一种氟化物。如今被添入牙膏预防龋齿的氟化物还有氟化钠和氟化锶等。专家们普遍认为,当提供的氟离子的浓度相等时,所有这些氟化物防治龋齿的作用是相同的。
龋齿可能是由口腔细菌在糖代谢过程中释放出来的有机酸穿透牙釉质表面使牙齿的矿物质——羟(基)磷灰石[Ca2(PO4)3OH]溶解造成的。由于细菌在牙齿表面形成一层黏附膜——齿斑(或称菌斑),这些有机酸能够长时间地跟牙齿表面密切接触,使羟(基)磷灰石溶解:
Ca5(PO4)3OH+4H+→5Ca2++
+H2O
饮水、食物和牙膏里的氟离子会跟羟(基)磷灰石发生沉淀的转化生成氟磷灰石:
Ca5(PO4)3OH+F-→Ca5(PO4)3F+OH-
溶解度研究证实氟磷石比羟磷灰石更能抵抗酸的侵蚀。这是由于氟离子体积小于氢氧根离子,在磷灰石晶体结构里更匹配。此外,氟离子还能抑制口腔细菌产酸。含氟牙膏已经使全世界千百万人减少龋齿,使人们的牙齿更健康。
练习:
1、向盛有0.1 mol/L AgNO3溶液的试管中滴加0.1 mol/L的NaCl溶液,至不再有白色沉淀生成为止。取其中澄清溶液,逐滴加入饱和Na2S溶液,有无沉淀生成?是否可以用Na2SO4代替Na2S?如果先向AgNO3溶液中加Na2S溶液至沉淀完全,再向上层清液中滴加NaCl,情况又如何?试解释原因。
2、在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时,为了除去Fe2+,常加入少量H2O2,使Fe2+氧化为Fe3+,然后再加少量碱至溶液Ph=4,可以达到除去铁离子而不损失硫酸铜的目的。试解释原因。
3、小结Ksp的大小与沉淀转化的关系。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -