1、已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++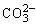 +H2O=Cu(OH)2↓+CO2↑
+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++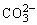 =CuCO3↓
=CuCO3↓
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
下列几种物质的溶解度大小的比较中,正确的是( )
A.CuS<Cu(OH)2<CuCO3 B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS D.Cu(OH)2<CuCO3<CuS
2、除去NaNO3溶液中混有的AgNO3,所用下列试剂中效果最好的是( )
A.NaCl溶液 B.NaBr溶液
C.NaI溶液 D.Na2S溶液
3、已知Ksp(AgCl)=1.8×10-10(mol·L-1)3,Ksp(AgBr)=5.0×10-13(mol·L-1)2,Ksp(AgI)=8.3×10-17(mol·L-1)2 。溶液中含有Cl-、Br-和I-三种离子,其浓度均为0.01mol·L-1,现向溶液中逐滴加入AgNO3溶液时,最先和最后沉淀的是( )
A.AgBr和AgI B.AgI和AgCl
C.AgBr和AgCl D.同时沉淀
4、已知Ksp(AB2)=4.2×10-8(mol·L-1)2,Ksp(AC)=3.0×10-15(mol·L-1)2。在AB2、AC均为饱和的混合液中,测得c(B-)=1.6×10-3mol·L-1,则溶液中c(C2-)为( )
A.1.8×10-13mol·L-1 B.7.3×10-13mol·L-1
C.2.3 mol·L-1 D.3.7 mol·L-1
5、对水垢的主要成分是CaCO3和Mg(OH)2,而不是CaCO3和MgCO3的原因解释,下列说法正确的是( )
A.Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化
B.Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化
C.MgCO3电离出的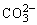 发生水解,促进水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp生成Mg(OH)2沉淀
发生水解,促进水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp生成Mg(OH)2沉淀
D.MgCO3电离出的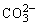 发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀
发生水解,促进水中OH-浓度增大,对Mg(OH)2沉淀溶解平衡而言,Qc>Ksp,生成Mg(OH)2沉淀
6、已知Ksp(Ag2SO4)=1.4×10-5(mol·L-1)3,Ksp(Ag2CO3)=8.1×10-12(mol·L-1)3,Ksp(AgCl)=1.8×10-10(mol·L-1)2,Ksp(AgI)=1.0×10-16(mol·L-1)2。在下述各银盐饱和溶液中,c(Ag+)由大到小的顺序为( )
A.Ag2SO4>AgCl>Ag2CO3>AgI
B.Ag2SO4>Ag2CO3>AgCl>AgI
C.Ag2SO4>AgCl>AgI>Ag2CO3
D.Ag2SO4>Ag2CO3>AgI>AgCl
7、SrCO3在下列溶液中溶解度最大的是( )
A.0.10 mol·L-1 CH3COOH
B.0.10 mol·L-1SrSO4
C.纯水
D.1.0 mol·L-1Na2CO3
8、将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,发生的反应为( )
A.只有AgBr沉淀生成
B.AgCl和AgBr沉淀等量生成
C.AgCl和AgBr沉淀都有,但以AgCl沉淀为主
D.AgCl和AgBr沉淀都有,但以AgBr沉淀为主
9、要除去铝壶中的水垢,所用的试剂为( )
A.浓硫酸 B.浓硝酸
C.浓盐酸 D.NaOH溶液
10、已知Ksp(AgCl)=1.8×10-10(mol·L-1)2,Ksp(AgI)=1.0×10-16(mol·L-1)2。下列关于难溶物之间的转化的说法中错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.两种难溶物的Ksp相差越大.难溶物就越容易转化为更难溶的物质
C.AgI比AgCl更难溶于水。所以AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转为AgI,则NaI的浓度必须不低于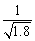 ×10-11mol·L-1
×10-11mol·L-1
11、当Cu2+溶液中混有少量Fe2+时。常用调节pH的方法来使Fe3+沉淀完全。因为当Fe3+沉淀完全时Cu2+还没有开始沉淀。有同学为探究当Mg2+溶液中混有少量Fe2+时,是否也可用上述方法进行除杂,特查阅有关数据如下:常温时,Ksp[Mg(OH)2]=4×10-12(mol·L-1)3,Ksp[Fe(OH)3]=8.0×10-38(mol·L-1)4;通常认为某离子残留在溶液中的浓度小于1.0×10-5mol·L-1时就认为该离子已经沉淀完全。假定原溶液中c(Mg2+)=1mol·L-1,c(Fe3+)=0.01 mol·L-1。(已知lg5=0.7)
(1)使Fe3+开始沉淀时溶液中pH约为___________;
(2)当Fe3+沉淀完全时溶液中c(OH-)约为___________mol·L-1;此时,Mg2+___________(填写编号:A.尚未开始沉淀;B.已经开始沉淀;C.已经沉淀完全);
(3)结论:在混有少量Fe3+的Mg2+溶液中,___________(填编号:A.可以;B.不可以)用调节pH的方法来除杂。
12、根据以下叙述,回答下列问题:
工业制备氯化铜时,是将浓盐酸用水蒸气加热至80℃左右,慢慢加入粗制CuO粉末(含杂质氧化亚铁),充分搅拌使之溶解得强酸性溶液,反应如下:CuO+2HCl=CuCl2+H2O,FeO+2HCl=FeCl2+H2O。已知pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀,pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀,pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中的Fe2+,可采用的方法是___________。(填代号)
A.直接加碱调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH到3~4
D.通入硫化氢,使Fe2+直接沉淀
(2)除去溶液中的Fe2+,有人用强氧化剂NaClO。
①当溶液加入NaClO后,溶液的pH变化情况是___________。(填代号)
A.肯定增大 B.肯定减小
C.可能减小 D.可能增大
②你认为用NaClO作氧化剂是否妥当? ___________(填“妥当”或“不妥当”),理由是___________。
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有___________。(填代号)
A.浓HNO3 B.KMnO4
C.Cl2 D.O2 E.H2O2
(3)除去溶液中Fe3+的方法是调节溶液的pH到3~4,现有下列试剂均可以使强酸性溶液的pH调节到3~4之间,可选用的有___________。(填代号)
A.NaOH B.氨水
C.Cu(OH)2CO3 D.Na2CO3 E.CuO