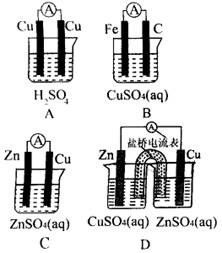
1、如图所示的装置中,能够组成原电池,产生电流的是( )
2、在理论上不能用于设计原电池的化学反应是( )
A.H2SO4(aq)+BaCl2(aq)=BaSO4(s)+2HCl(aq) △H<0
B.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H<0
C.4Fe(OH)2(s)+2H2O(1)+O2(g)=4Fe(OH)3(s) △H<0
D.3Cu(s)+8HNO3(aq)=3Cu(NO3)2(aq)+2NO(g)+4H2O(1) △H<0
3、“嫦娥一号”绕月运行的近两年中,主要依靠卫星上的太阳能帆板接受太阳照射放电,但期间曾遭遇几次月食,发生月食时,“嫦娥一号”会和月球一起进入几个小时的黑暗时光,此时依靠自带的高性能蓄电池供电。“嫦娥一号”卫星的太阳能电池和高性能蓄电池都是根据原电池原理制造的。下列有关原电池的说法中正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.在原电池中,电子流出的一极是负极,该电极被还原
C.原电池工作时,阴离子向负极方向移动
D.原电池工作时,电流的方向是从负极到正极
4、图为一原电池的结构示意图。下列说法中,不正确的是( )
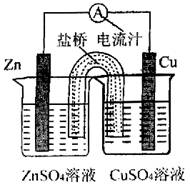
A.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu,该反应一定为放热反应
B.原电池工作时,Zn电极流出电子,发生氧化反应
C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深
D.如果将Cu电极改为Fe电极,Zn电极依然作负极
5、一个原电池的总反应的离子方程式是:Zn+Cu2+=Cu+Zn2+,该原电池的正确组成是( )
|
A |
B |
C |
D |
正极 |
Zn |
Cu |
Zn |
Fe |
负极 |
Cu |
Zn |
Zn |
Zn |
电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
6、实验室中欲快速制取氢气,最好的方法应该是( )
A.纯锌与稀H2SO4 B.纯锌与浓H2SO4
C.粗锌与稀HNO3 D.粗锌与稀H2SO4
7、根据下列事实可知X、Y、Z、W的还原性由强到弱的顺序是( )
①X+Y2+=X2++Y
②Z+2H2O=Z(OH)2+H2↑
③Z2+的氧化性比X2+弱
④由Y、W电极组成的原电池,电极反应式为W2++2e-=W,Y-2e-=Y2+
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
8、有关电化学知识的描述正确的是( )
A.CaO+H2O=Ca(OH)2,可以放出大量的热,故可以把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池Cu+2AgNO3=Cu(NO3)2+2Ag,装置中的盐桥可以是装有琼胶的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能形成原电池,必足铁作负极,铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可以设计成原电池
9、如图所示的原电池装置,X、Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是( )
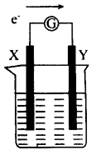
A.外电路中的电流方向为:X→外电路→Y
B.若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两个电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
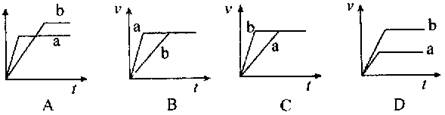
10、将等质量且过量的两份锌粉a、b中分别加入相同体积、相同物质的量浓度的稀硫酸,同时向a中加入少量硫酸铜溶液,下列各图产生H2的体积V(L)与时间t(min)的关系中正确的是( )
11、如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓的CuSO4溶液,一段时间后,下列有关杠杆的偏向(实验过程中,不考虑铁丝反应及两球的浮力变化)的判断正确的是( )
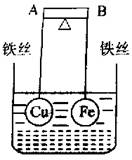
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
12、如图所示实验中,把四根洁净的金属条A、B、C、D轮流放置在浸有盐溶液的滤纸上面并压紧。在每次轮流实验时,记录了电压表指针的移动方向和电压表的读数(如下表)。
金属 |
电子流动 |
电压 |
A |
A→Cu |
+0.78 |
B |
Cu→B |
-2.15 |
C |
C→Cu |
+1.35 |
D |
|
+0.30 |
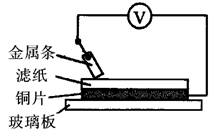
(1)金属D与Cu之间的电子流动方向为___________;
(2)___________金属可能是最强的还原剂;
(3)___________金属不能从硫酸铜溶液中置换出铜。
13、依据氧化还原反应:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s),设计的原电池如图所示。请回答相关问题:
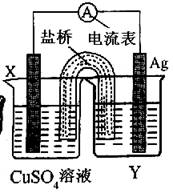
(1)电极X的材料是___________;电解质溶液Y是___________。
(2)银电极为电池的___________极,发生的电极反应为___________,X电极上发生的电极反应为___________。
14、有甲、乙两位同学均想利用原电池反应验证金属的话动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6 mol·L-1H2SO4溶液中,乙同学将电极放入6mol·L-1NaOH溶液中,如图所示:
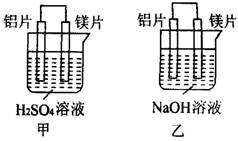
请完成下列问题:
(1)写出甲池中正极的电极反应式:______________________。
(2)乙池中铝片作___________(填“正极”或“负极”),理由是______________________。
(3)如果甲、乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出___________活动性更强,而乙会判断出___________活动性更强。(填写元素符号)
(4)由此实验,可得到如下哪些正确结论? ___________(填写字母序号)
a.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b.镁的金属性不一定比锚的金属性强
c.该实验说明金属性活动性顺序表已过时,已没有应用价值
d.该实验说明化学研究对象复杂,反应受条件的影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断电池中的正负极”的这种说法___________(填“可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行性实验方案______________________。(如可靠,此空可不填)