例1、(安徽)Cu2O是一种半导体材料,基于绿色化学理念设计的制取。Cu2O的电解池示意图如下,电解总反应:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
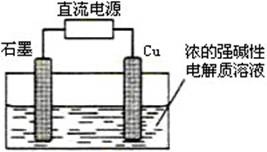
 A.石墨电极上产生氢气
A.石墨电极上产生氢气
 B.铜电极发生还原反应
B.铜电极发生还原反应
 C.铜电极接直流电源的负极
C.铜电极接直流电源的负极
 D.当有0.1mol电子转移时,有0.1molCu2O生成。
D.当有0.1mol电子转移时,有0.1molCu2O生成。
解析:
Cu失电子,为阳极,与铜相连的为电源正极,石墨为阴极,与石墨相连的为电源负极。Cu电极为阳极,电极反应式:2Cu+2OH--2e-=Cu2O+H2O,失电子,发生氧化反应;当有2mol电子通过时,生成1mol Cu2O,当有0.1mol电子通过时,生成0.05mol Cu2O。
石墨电极为阴极,电极反应式反应式为:2H2O+2e-=2OH-+H2↑。
 答案:A
答案:A
例2、(重庆卷)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
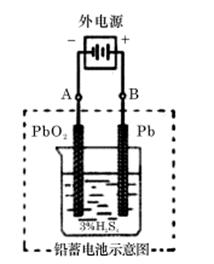
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按题图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将__________________。
解析:
(1)根据电池的总反应式:Pb+PbO2+4H++2SO42― 2PbSO4+H2O,电池在放电时,Pb为电池的负极,电极反应为:Pb-2e-+SO42―=PbSO4;PbO2为电池的正极,电极反应为:PbO2+2e-+4H++SO42―=PbSO4+2H2O。在放电时,H2SO4被消耗,其浓度将变小。负极板质量增加的质量是SO42―的质量(PbSO4难溶)根据2e-~SO42―可得当外电路通过1mol电子时,理论上负极板的质量增加0.5mol×96g/mol=48g。
2PbSO4+H2O,电池在放电时,Pb为电池的负极,电极反应为:Pb-2e-+SO42―=PbSO4;PbO2为电池的正极,电极反应为:PbO2+2e-+4H++SO42―=PbSO4+2H2O。在放电时,H2SO4被消耗,其浓度将变小。负极板质量增加的质量是SO42―的质量(PbSO4难溶)根据2e-~SO42―可得当外电路通过1mol电子时,理论上负极板的质量增加0.5mol×96g/mol=48g。
(2)按照图示的连接,是给蓄电池充电,两极分为阴阳,阴极(A极)就是接电源负极,发生还原反应,得电子,相当于电池放电时的负极反应倒写(改为从右往左):PbSO4+2e-=Pb+SO42―,故A极上生成Pb;阳极(B极)就是接电源正极,发生氧化反应,失电子,相当于电池放电时的正极反应倒写(改为从右往左) PbSO4+2H2O =PbO2+2e-+4H++SO42―,故B极上生成PbO2,此时铅蓄电池的正负极的极性恰好对换。
答案:
(1)PbO2+2e-+4H++SO42―=PbSO4+2H2O;小;48
(2)Pb;PbO2;对换