| 电解原理 |
主编:黄冈中学化学集体备课组
(讲)前面我们学过原电池,原电池是将化学能转化为电能的装置。电能也可以转化为化学能,电能转化为化学能。
(板书)
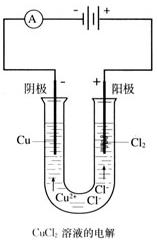
(演示实验)将两根碳棒分别跟直流电源的正极和负极相连接,浸入U形管内的CuCl2溶液中,再接通直流电,与电源正极相连的碳棒上有气泡产生,用湿润的KI淀粉试纸检验变蓝,说明为Cl2。与电源负极相连的碳棒上附着的有红色物质,说明为Cu。
结论:没有接通直流电时,两根碳棒无论是否用导线相连,都不能使CuCl2溶液发生变化。但是,在直流电的作用下,溶液中的CuCl2被分解了,实现了电能转化为化学能的过程。
(过渡)CuCl2溶液在电流的作用下为什么会分解生成Cu和Cl2呢?
板书分析:
CuCl2=Cu2++2Cl-
阴极:Cu2++2e-=Cu(还原反应)
阳极:2Cl-—2e-=Cl2↑(氧化反应)
总反应:CuCl2
Cu+Cl2↑
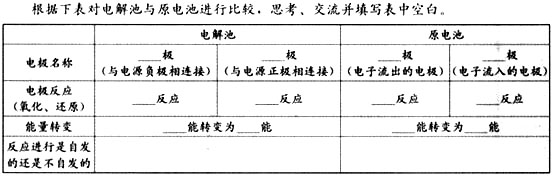
(讲)像这样把电能转化为化学能的装置叫电解池(或电解槽)
(板书)
一、电解池:把电能转化为化学能的装置
(讲)使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。电解质溶液导电的过程,就是电解质溶液电解的过程。电解池的电极我们称为阴极和阳极。
(过渡)如何判断电解池的阴、阳两极呢?
二、电解池的两极
回到CuCl2电解的电极反应中,板书阴极、阳极、还原反应、氧化反应。
(讲)电解究竟是怎样进行的呢?
三、电解的原理
未通电前,Cu2+与Cl-在溶液中作自由运动。
通电后,在电极的作用下,这些自由运动的离子改作定向运动,即阳离子趋向阴极,阴离子趋向阳极。当这些离子到达电极时,就失去或获得电子,发生氧化还原反应,这个过程叫做放电。
(提问)为何是Cl-失电子,而不是碳棒失电子?
(提问)CuCl2溶液中除了Cu2+、Cl-外,还有其它阴、阳离子吗?(H+、OH-)
H2O
H++OH-
(提问)为什么不是OH-或H+放电呢?
四、离子的放电顺序
(讲)阴极上阳离子得到电子发生还原反应,阳离子得电子能力越强,越容易放电。因此,阳离子的放电顺序与阳离子氧化性相对应。(与金属活动性顺序恰好相反)
(板书)阴极:
Ag+>Hg2+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+>K+
(讲)阳极上发生氧化反应,阴离子失电子能力越强,越易放电。因此阴离子的放电顺序与其还原性相对,如果阳极为活泼电极,则活泼电极先于任何阴离子放电。
(板书)阳极:
活泼电极>S2->I->Br->Cl->OH->含氧酸根
(讲)我们讲的离子的放电顺序为一般规律,而实际上离子在两极上放电的情况比较复杂,与离子性质、溶液浓度等都有关系,实际上有可能不一定严格按照此顺序。
思考与交流:
练习:用石墨为电极,电解下列溶液,试写出电极反应式。
(1)NaOH溶液 (2)H2SO4溶液 (3)HCl溶液
分析:
阳离子:Na+<H+;阴极:4H++4e-=2H2↑
阴离子:OH-;阳极:4OH--4e-=O2↑+2H2O
总反应:2H2O
2H2↑+O2↑
(2)H2SO4溶液
阳离子:H+;阴极:2H++2e-=H2↑
阴离子:OH->
;阳极:4OH--4e-=2H2O+O2↑
总反应:2H2O
2H2↑+O2↑
总结:电解NaOH与H2SO4溶液的本质即为电解H2O,初中学过的电解H2O的实验,实际上是电解稀H2SO4和稀NaOH溶液,因为纯水的导电性很弱。
说明:含氧酸溶液、强碱溶液以及活泼金属含氧酸盐溶液的电解,实质为电解水,电解质本身起增强水的导电性的作用。
(3)HCl溶液
阳离子:H+;阴极:2H++2e-=H2↑
阴离子:Cl->OH-;阳极:2Cl--2e-=Cl2↑
总反应:2HCl
H2↑+Cl2↑
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -