|
一、选择题
1、有关电解原理的说法正确的是( )
①电解是把电能转变成化学能 ②电解是把化学能转变成电能 ③不能自发进行的氧化还原反应,通过电解的原理可以实现 ④任何溶液被电解时,必然导致氧化还原反应的发生
A.①②③④ B.②③
C.① D.①③④
2、可以将反应Zn+Br2=ZnBr2设计成蓄电池,下列4个电极反应:①Br2+2e—=2Br- ②2Br--2e-=Br2 ③Zn-2e-=Zn2+ ④Zn2++2e-=Zn
其中表示充电时的阳极反应和放电时的负极反应的分别是( )
A.②和③ B.②和①
C.③和① D.④和①
3、用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(括号内),溶液能与原来溶液完全一样的是( )
A.CuSO4[Cu(OH)2] B.NaOH[NaOH]
C.NaCl[盐酸] D.AgNO3[Ag2O]
4、如图所示两个电解槽中,A、B、C、D均为石墨电极。如果电解过程中共有0.02 mol电子通过,下列叙述中正确的是( )
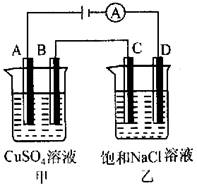
A.甲烧杯中A极上最多可析出铜0.64 g
B.甲烧杯中B极上电极反应式为4OH--4e-=2H2O+O2↑
C.乙烧杯中滴入酚酞试液,D极附近变红
D.乙烧杯中C极上电极反应式为4H++4e-=2H2↑
5、某溶液中含有溶质NaCl和H2SO4,它们的物质的量之比为3∶1。用石墨作电极电解溶液时,根据电极产物,电解过程明显分为三个阶段。下列叙述不正确的是( )
A.阴极只析出H2
B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水
D.溶液pH不断增大,最后为7
6、以铂为电极,电解含有0.10 mol M+和0.10 mol N3+(M+和N3+均为金属离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示。通过分析判断,下列离子的氧化能力强弱顺序正确的是( )
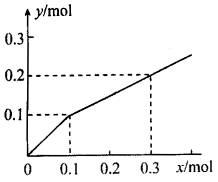
A.M+>N3+>H+ B.M+>H+>N3+
C.N3+>H+>M+ D.H+>M+>N3+
7、关于电解槽的叙述中,不正确的是( )
A.电解槽的阳极发生氧化反应
B.与电源正极相连的是电解槽的阴极
C.电子从电源的负极沿导线流入电解槽的阴极
D.参与电解的阳离子往阴极移动
8、用石墨为电极电解CuSO4和KCl的混合溶液,电解初期阴极和阳极分别析出的物质是( )
A.H2、Cl2 B.Cu、Cl2
C.H2、O2 D.Cu、O2
9、根据金属活动性顺序表,Cu不能发生:Cu+2H2O=Cu(OH)2+H2↑的反应。但是选择恰当的电极材料和电解质溶液进行电解,这个反应就能实现。下列四组电极和电解质溶液中,能实现该反应最为恰当的一组是( )
|
A |
B |
C |
D |
阳极 |
石墨棒 |
Cu |
Cu |
Cu |
阴极 |
石墨棒 |
石墨棒 |
Fe |
Pt |
电解质溶液 |
CuSO4溶液 |
Na2SO4溶液 |
H2SO4溶液 |
CuSO4溶液 |
10、将两支惰性电极插入500 mL AgNO3溶液中,通电电解,当电解液的pH从6.0变为3.0时(设阴极没有H2放出,且电解液体积不变)。电极上应析出银的质量大约是( )
A.27 mg B.54 mg
C.108 mg D.216mg
二、填空题
11、如图,将铜片和锌片焊接在一起组成A电极,B为碳棒,进行电解实验,电解液中含硝酸银和硝酸铜各0.1 mol。已知电路中通过0.2 mol电子。
(1)请写出A、B两极发生反应的电极反应式。
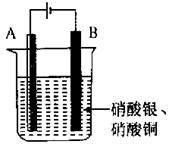
A:__________________________________________
B:__________________________________________
(2)请分析A、B两极质量变化情况为
A:__________________________________________
B:__________________________________________
显示答案
|
11、(1)A:Zn-2e-=Zn2+;B:2Ag++2e-=2Ag;Cu2++2e-=Cu
(2)A:减少6.5g;B:增加14g |
12、如图所示,若电解5 min,测得铜电极质量增加2.16 g。试回答:
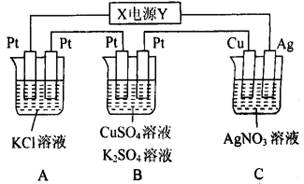
(1)电源中X极是____________(填“正”或“负”)。
(2)通电5 min时,B中共收集到224 mL(标准状况)气体,溶液体积为200 mL(电解前后溶液的体积变化忽略不计),则通电前c(CuSO4)= ____________。
(3)若A中KCl溶液的体积也为200 mL,则电解后溶液的pH=____________。
显示答案
|
12、(1)负
(2)0.025mol·L-1
(3)13 |
13、电解装置如图所示,图中B装置中是1 L 2 mol·L-1的Na2SO4溶液,A装置中是1 L 2 mol·L-1的AgNO3溶液,通电后,湿润的淀粉KI试纸的C端变蓝色,电解一段时间后,试回答:
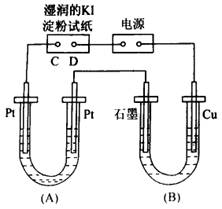
(1)A中发生反应的化学方程式为________________________。
(2)在B中观察到的现象是________________________。
(3)室温下,若以电解开始到时间t秒时,A、B装置中共收集到气体0.168 L(标准状况),若电解过程无其他副反应,且溶液的体积忽略不计,则在t秒时,A溶液的pH为____________。
显示答案
|
13、(1)4AgNO3+2H2O 4Ag+O2↑+4HNO3 4Ag+O2↑+4HNO3
(2)石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后,U形管下部有蓝色沉淀生成
(3)2 |
14、大家知道:Cu+H2SO4(稀)=CuSO4+H2↑通常不能反应。请回答:
(1)试说明此反应在一般条件下不能反应的原因是________________________。
(2)若向稀H2SO4溶液中通入热的空气,则发现铜逐渐溶解。试写出有关的化学方程式________________________。
(3)根据你所学过的知识,设法使此反应发生。请画出实现该反应的装置图,并写出电极反应式。
显示答案
|
14、(1)因铜在金属活动性顺序表中排在氢的后面,所以不能与稀硫酸反应置换出酸中的H+
(2)2Cu+O2+2H2SO4(稀)=2CuSO4+2H2O
(3)
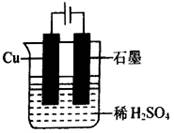
阳极:Cu-2e-=Cu2+,
阴极:2H++2e-=H2↑ |
|