| 氯碱工业 |
主编:黄冈中学化学集体备课组
(讲)电解原理在工业生产中的应用很多,烧碱和氯气是金属化工原料,工业上常用电解饱和食盐水的方法来制取H2、Cl2和NaOH,并以它们为原料生产一系列化工产品。习惯上把电解饱和食盐水的工业生产叫做氯碱工业。
(板书)
一、氯碱工业
(提问)电解饱和食盐水是怎样的过程呢?我们通过实验来探究。
(提问)观察到什么现象?
①与电源正极相连的碳棒(阳极)有气泡产生,生成的气体能使湿润的KI淀粉试纸变蓝。(说明有Cl2生成)
②与电源负极相连的铁棒(阴极)有气泡产生,且此边U形管中滴有酚酞的溶液变红,说明有碱性物质生成,应为NaOH。
(思考)电解饱和食盐水为什么得到这些产物呢?
(板书)
1、电解饱和食盐水反应原理
(板书)通电前:NaCl=Na++Cl-
H2O
H++OH-
通电后:Na+、H+→阴极(Fe)
Cl-、OH-→阳极(C)
(讲)由于离子放电顺序:H+>Na+,Cl->OH-。
阳极(C):2Cl--2e-=Cl2↑(氧化反应)
阴极(Fe):2H++2e-=H2↑(还原反应)
(提问)NaOH为什么在阴极区生成?
在阴极上,由于大量H+放电生成H2逸出,局部破坏水的电离平衡,造成阴极区附近OH-数目增多,故NaOH在阴极区生成。
阴极反应式也可写为:2H2O+2e-=2OH-+H2↑
(板书)总反应:
将电极反应式改为总反应式时,若参加反应的H+和OH-是水电离产生的,写总反应式时,反应物应写H2O。
(提问)此实验中,电极材料均用石墨棒可否?可以,惰性电极材料。
电极材料均用铁棒可否?不行,因为阳极材料若用Fe,Fe为活泼电极,会先于Cl-放电,得到的就是Fe-2e-=Fe2+,而不是Cl2了。
(讲)以上是从理论上分析电解饱和食盐水的反应原理,但实际生产中远比这复杂。因为电解产物间可以相互反应。如:
(副版)Cl2+2NaOH=NaCl+NaClO+H2O(影响产品质量)
H2+Cl2
2HCl(爆炸)
(讲)实际工业生产中是在专门的电解槽中进行,避免这些问题的发生。
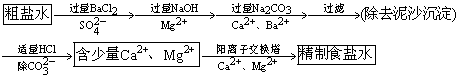
(讲)由于粗盐中含有泥沙,Ca2+、Mg2+、
等杂质,首先应除去这些杂质,得到精制饱和食盐水。如何精制呢?
2、精制饱和食盐水(除
、Mg2+、Ca2+)
(板书)
强调:
①加入除杂剂,必须过量。
②Na2CO3在BaCl2之后,HCl在Na2CO3过滤之后。
(讲)电解原理的又一应用为电冶金。
二、电冶金(电解熔融物制活泼金属)
(讲)金属冶炼就是使矿石的金属离子获得电子,从它们的化合物中还原出来。
Mn++ne-=M
由于电解是最强有力的氧化还原手段,电解法是冶炼金属的一种重要方法,对于冶炼像Na、Ca、Mg、Al等活泼金属,电解法是唯一可行的工业方法。
1、电解熔融的氯化钠
阳极:2Cl-— 2e-=Cl2↑
阴极:2Na++2e-=2Na
总反应:2NaCl(熔融)
2Na+Cl2↑
2、电解熔融的氧化铝
阳极:6O2-— 12e-=3O2↑
阴极:4Al3++12e-=4Al
前反应:2Al2O3(熔融)
4Al+3O2↑
3、电解熔融的氯化镁
阳极:2Cl-— 2e-=Cl2↑
阴极:Mg++2e-=Mg
总反应:MgCl2 (熔融)
Mg+Cl2↑
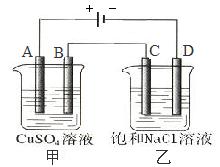
练习:在下图中,电烧杯中盛有CuSO4溶液,乙烧杯中盛有饱和NaCl溶液,A、B、C、D均为石墨电极,如果电解过程中共有0.02mol电子通过,则甲烧杯中_________极上最多可析出铜_________g,_________极上析出_________气_________mL(标准状况)。在乙烧杯中溶入酚酞,_________极附近变红,在乙烧杯中最终得到_________溶液。
答案:B;0.64; A;氧;112;D;NaClO。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -