1、关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
2、用普通食盐进行电解饱和食盐水的实验,食盐水装在U形管内,结果很快在某一电极附近出现食盐水浑浊现象。造成浑浊的难溶物主要是( )
A.碳酸镁 B.硫酸钡
C.氢氧化镁 D.碳酸钡
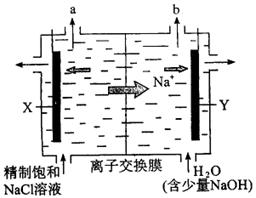
3、化学工业中的离子交换膜就是一些具有特定微粒通道的物质:阳离子交换膜只允许阳离子通过.而阻止阴离子和气体通过;阴离子交换膜只允许阴离子通过,而阻止阳离子和气体通过。目前世界上比较先进的电解制碱技术是离子交换膜法。如下图是工业上离子交换膜法电解饱和NaCl溶液生成烧碱的原理示意图,其中的离子交换膜是( )
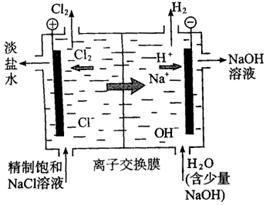
A.石棉隔膜 B.阳离子交换膜
C.阴离子交换膜 D.活性生物细胞膜
4、海水提镁的最后一步是将氯化镁电解获取金属镁。下列有关该电解过程的叙述中,正确的是( )
A.两个电极必须都用惰性电极
B.阳极必须用惰性电极,阴极可以是惰性电极也可以是金属电极
C.电解熔融状态的氯化镁
D.电解氯化镁的水溶液
5、某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是( )
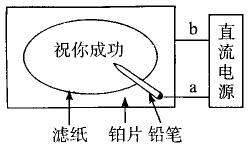
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
6、下列说法正确的是( )
A.电解饱和食盐水的工厂可以生产盐酸
B.电解饱和食盐水在阴极区有NaOH固体生成
C.用离子交换膜法制烧碱不会对环境造成污染
D.氯碱工业产品可用于造纸、金属冶炼等行业
7、用铂作电极电解某种溶液,通电一段时间,溶液的pH变小,并且在阳极得到0.56 L气体,阴极得到1.12 L气体(两种气体均在相同条件下测定)。由此可知溶液可能是( )
A.稀盐酸 B.KNO3溶液
C.CuSO4溶液 D.稀硫酸
8、因发生电极反应,直接破坏了该电极附近水的电离平衡的是( )
A.电解氯化铜溶液时的阴极
B.铜铁原电池的负极(硫酸溶液为电解质)
C.电解食盐水时的阴极
D.铁片上镀锌时的阴极
9、某同学设计了一种电解法制取Fe(OH)2的实验装置(如图)。通电后,溶液中产生白色沉淀,且较长时同不变色。下列说法中正确的是( )
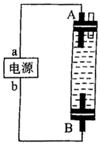
A.电源中“a”为正极,“b”为负极
B.电解池中的电解液可以是NaOH溶液但不能是NaCl溶液
C.A、B随端都必须使用铁作电极
D.B电极发生的反应为2H2O+2e-=H2↑十2OH-
10、实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
正极:Pb+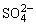 =PbSO4+2e-
=PbSO4+2e-
负极:PbO2+5H++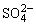 +2e-=PbSO4+2H2O
+2e-=PbSO4+2H2O
今若制得Cl2 0.050 mol,这时也池内消耗的H2SO4的物质的量至少是( )
A.0.025 mol B.0.050 mol
C.0.10 mol D.0.20 mol
11、如下图所示装置,用离子交换膜法电解饱和食盐水制烧碱。现有含Mg2+、Ca2+、Fe3+和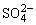 杂质的粗盐,需对其提纯得到NaCl溶液,用以电解制备烧碱。请完成下列问题:
杂质的粗盐,需对其提纯得到NaCl溶液,用以电解制备烧碱。请完成下列问题:
(1)提纯:将粗盐溶于水,需加入过量的①NaOH溶液、②Na2CO3溶液、③BaCl2溶液,其加入的顺序可以是___________。
A.①②③ B.③②①
C.②③① D.①③②
待沉淀完全后,除去沉淀所需进行的操作名称是___________;最后加入盐酸调节盐水的pH为7。
(2)电解:若X电极材料为金属钛网(表面有氧化物涂层),Y电极材料为碳钢网。阳离子交换膜只允许阳离子通过,而阻止阴离子和气体通过。分别收集两极产生的气体并通入淀粉KI溶液中。
请完成下列问题:
①能使淀粉KI溶液变蓝的是___________(填“a”或“b”)气体;
②其阳极的电极反应式为___________,阴极的电极反应式为___________;
③总反应的化学方程式为______________________。
13、电解原理在化学工业中有广泛应用,下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。

请完成以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为___________。在X极附近观察到的现象是___________。
②Y电极上的电极反应式为___________,检验该电极反应产物的方法是___________。