1、下列描述中,不符合生产实际的是( )
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
2、用惰性电极进行电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
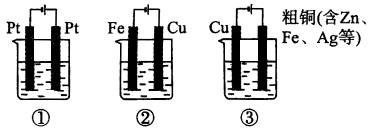
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
3、如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味的气体放出。符合这一情况的是下表中的( )
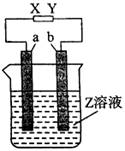
组合 |
a极板 |
b极板 |
X极 |
Z溶液 |
A |
锌 |
石墨 |
负极 |
CuSO4 |
B |
石墨 |
石墨 |
负极 |
NaOH |
C |
银 |
铁 |
正极 |
AgNO3 |
D |
铜 |
石墨 |
负极 |
CuCl2 |
4、将质量分数为0.052的NaOH溶液1 L(密度为1.06 g·cm-3)用铂电极电解,当溶液中NaOH的质量分数改变了0.010时停止电解,则这时溶液中应符合的关系是( )
|
NaOH的
质量分数 |
阳极析出的
物质的质量/g |
阴极析出的
物质的质量/g |
A |
0.062 |
19 |
152 |
B |
0.062 |
152 |
19 |
C |
0.042 |
1.2 |
9.4 |
D |
0.042 |
9.4 |
1.2 |
5、用石墨作电极电解1 L 1mol·L-1CuSO4溶液,当c(Cu2+)为0.5 mol·L-1时,停止电解,向剩余溶液中加入下列何种物质可使电解质溶液恢复至原来状况( )
A.CuSO4 B.CuO
C.Cu(OH)2 D.CuSO4·5H2O
6、CuI是一种不溶于水的白色固体,它可由反应2Cu2++4I-=2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前的电解液中加入少量酚酞和淀粉溶液,电解开始不久,阴极区溶液呈现红色,而阳极区溶液呈现蓝色。对这个现象的正确解释是( )
①阴极电极反应2H++2e-=H2↑使c(OH-)>c(H+) ②阳极2Cu+4I--4e-=2CuI↓+I2,淀粉遇I2变蓝 ③阳极Cu-2e-=Cu2+,Cu2+显蓝色 ④电极2I--2e-=I2,淀粉遇I2变蓝
A.①② B.①③
C.①④ D.③④
7、火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时( )
A.粗铜接电源负极
B.纯铜作阴极
C.杂质都将以单质形式沉积到池底
D.纯铜片增重2.56 g,电路中通过电子为0.04mol
8、如图所示,3个电解装置中都盛有相同体积和相同物质的量浓度的CuSO4溶液,通电一段时间并且通过相同的电量时,CuSO4溶液的物质的量浓度的大小关系正确的是( )
A.①>②>③ B.②>③>①
C.②=③>① D.①=②=③
9、如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.11 mol·L-1,工作一段时间后,测得导线中均通过0.02 mol电子。若不考虑盐的水解和溶液体积的变化,则下列叙述正确的是( )
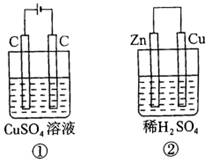
A.产生气体的体积:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式:①中阳极:4OH--4e-=2H2O+O2↑;②中负极:2H++2e-=H2↑
10、用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,且已知Fe2(SO4)3+Cu=2FeSO4+CuSO4,下列说法正确的是( )
A.阴极反应式为Cu2++2e-=Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.首先被电解的是Fe2(SO4)3溶液,而后被电解的是CuSO4溶液
D.阴极上不可能析出铜
11、用如图所示的装置进行电解。通电一会儿,发现湿润的KI-淀粉试纸的C端变为蓝色。则:
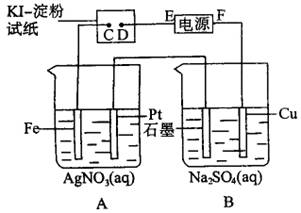
(1)A中发生反应的化学方程式为______________。
(2)在B中观察到的现象是______________、______________、______________。
12、新型高能钠硫电池以熔融的钠、硫为电极,以钠离子导电的陶瓷为固体电解质。该电池放电时为原电池,充电时为电解池。反应原理为2Na+xS Na2Sx。
Na2Sx。
(1)放电时S发生______________反应,Na作______________极。
(2)充电时Na所在电极与直流电源______________极相连。
(3)充电时阳极反应为______________;放电时负极反应为______________ 。
(4)用此电池作电源电解饱和NaCl溶液,当阳极产生11.2 L(标准状况)气体时,消耗金属钠______________g。
13、分析下图装置,回答问题。
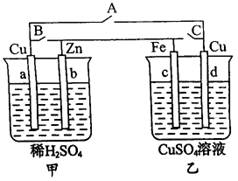
(1)当A键断开,B、C两键闭合时,甲为______________池,乙为______________池。
(2)当A、C两键断开时,乙中铁极增重1.6 g,则被氧化的铁有______________g。
(3)将乙中两极都换成石墨,硫酸铜溶液换成硫酸后断开A键,闭合B、C两键,则甲为______________,乙为______________。当甲中的锌减轻6.5 g时,乙中共放出气体(标准状况) ______________mL。
14、如图所示,E为蘸有Na2SO4溶液的滤纸,并加入几滴酚酞。A、B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni的电极材料制成,它在碱溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,K打开,接通电源一段时间后,C、D中有气体产生。
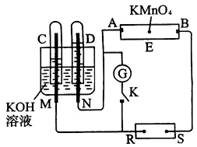
(1)外电源的正、负分别是R为______________,S为______________。
(2)A附近溶液的现象是______________,B附近发生的电极反应式为______________。
(3)滤纸上的紫色点向哪方移动______________。
(4)当C、D中的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,主要因为______________,有关的反应式为______________。