| 金属的电化学腐蚀与防护 |
主编:黄冈中学化学集体备课组
(讲)在日常生活中我们经常可以看到,一些美观的金属器皿使用一段时间后会失去表面的光泽,如铁器会生锈,铜器会长出铜绿,这就是金属腐蚀的现象。金属腐蚀的现象十分严重,全世界生产的金属大约有
被腐蚀,研究金属的腐蚀和防护具有重要的意义。
一、金属的腐蚀
1、定义:金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象。
2、本质:M-ne-=Mn+
3、分类
(过渡)生产和日常生活中比较普遍且危害较大的是金属的电化学腐蚀,钢铁在潮湿的空气中生锈,是典型的电化学腐蚀。
(板书)4、析氢腐蚀
(讲)钢铁是Fe-C合金,在潮湿的空气中表面会形成一薄层水膜,水膜溶解有来自大气中的CO2、SO2、H2S等气体,使水膜中含有一定量的H+,这样在钢铁的表面形成了一层电解质溶液的薄膜,它与钢铁里的Fe和少量的碳构成了原电池。
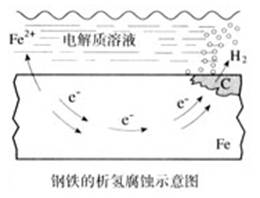
负极(Fe):Fe-2e-=Fe2+
正极(C):2H++2e-=H2↑
总反应:Fe+2H+=Fe2++H2↑
(讲)由于在腐蚀过程中不断有H2放出,所以叫做析氢腐蚀。
(讲)一般情况下,如果钢铁表面吸附的水膜酸性很弱或呈中性,但没有一定量的氧气,此时就会发生吸氧腐蚀。
5、吸氧腐蚀(弱酸性或中性环境)
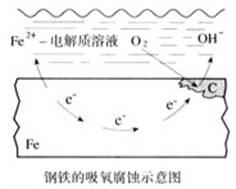
负极(Fe):2Fe-4e-=2Fe2+
正极(C):O2+2H2O+4e-=4OH-
总反应:2Fe+2H2O+O2=2Fe(OH)2
(讲)生成的Fe(OH)2不稳定,很容易被氧化成Fe(OH)3。
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3脱水生成Fe2O3·xH2O(铁锈),疏松地覆盖在钢铁表面,使电解质溶液渗入钢铁内部,形成更多的Fe-C原电池,钢铁继续腐蚀。
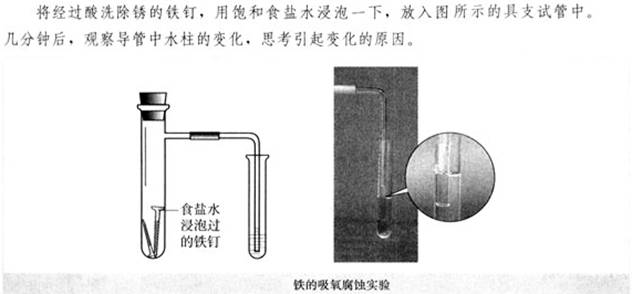
实验:
(过渡)人们认识到金属发生电化学腐蚀的原因是在金属表面形成了原电池。反过来,人们也利用原电池原理来保护金属,使它们不被腐蚀。
二、金属的电化学防护
1、牺牲阳极的阴极保护法
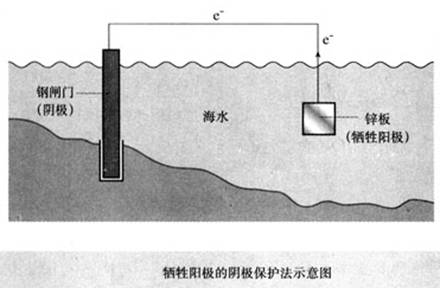
2、外加电流的阴极保护法
总结:将被保护的金属作为原电池的正极或电解池的阴极,不参与电极反应,从而不会被氧化。
(讲)除了电化学防腐蚀外,金属防腐的方法还有很多种。例如把金属制成防腐的合金,如不锈钢,还可以采用喷油漆、涂油脂、电镀等其它方法使金属与空气、水等物质隔离,以防止金属腐蚀。
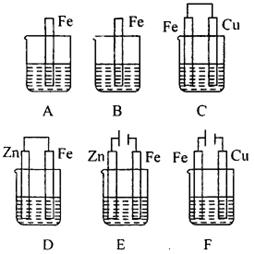
练习:如图所示,除A烧杯中盛水外,其余烧杯中分别盛有相同物质的量浓度的稀硫酸。
(1)C中Cu极的电极反应式为___________,Cu极附近溶液的pH___________(填“增大”、“减小”或“不变”)。
(2)E中被腐蚀的金属是___________,总反应的离子方程式是___________。
(3)比较烧杯中铁被腐蚀的速率由快到慢的顺序是___________。
答案:
(1)2H++2e-=H2↑;增大
(2)Zn;Zn+2H+=Zn2++H2↑
(3)F、C、B、A、D、E
分析:
腐蚀程度大小顺序:
电解原理引起的腐蚀(电解池的阳极)>原电池原理引起的腐蚀(原电池的负极)>化学腐蚀>有防护措施的腐蚀。
防腐措施由好到差为:
外加电流的阴极保护法>牺牲阳极的阴极保护法>有一般防护条件的防腐法>无防护条件的防腐。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -