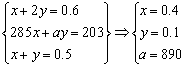| 化学反应热的计算 |
主编:黄冈中学化学集体备课组
(引)化学反应的反应热有的可直接测得,而有些反应的反应热不能直接测得。
如:
△H ?
这个反应在O2供应充分时,可燃烧生成CO2;O2供应不充分时,虽可生成CO,但同时这部分生成CO2,因此反应的△H无法直接测得。对于这种反应的产品不纯,或反应进行很慢或反应不容易直接发生的反应,反应热都无法直接测得。我们可以通过计算间接求得。反应热的计算主要用盖斯定律,下面我们就来学习盖斯定律及其应用。盖斯定律是瑞士化学家盖斯,通过大量实验总结出来的定律。
一、盖斯定律
大量实验事实证明,化学反应不论是一步完成还是分几步完成,其反应热是相同的,换句话说,化学反应的反应热与反应体系的始态(反应物)和终态(生成物)有关,而与反应途径无关。若一个反应可分几步进行,则各步反应的反应热之和与该反应一步完成时的反应热相同。
如:
△H=△H1+△H2
或△H1=△H-△H2
化学方程式可以进行叠加,其对应的反应热也可以进行叠加。
(副版)
如:(1)C(s)+O2(g)=CO2(g) △H1
(2)CO(g)+
O2(g)=CO2(g) △H2
(3)C(s)+
O2(g)=CO(g) △H3
∵(2)+(3)=(1)
即△H2+△H3=△H1
∴△H3=△H1 -△H2
例1、25℃、101kPa时,将1.0g钠跟足量的氯气反应,生成氯化钠晶体并放出17.87kJ的热量,求生成1mol氯化钠的反应热。
解:
钠与氯气起反应的化学方程式如下:
Na(s)+
Cl2(g)=NaCl(s)
1mol Na反应后生成1mol NaCl
Na的摩尔质量是23g/mol
设生成1mol NaCl的反应热为x
1.0g∶23g/mol=-17.87kJ∶x
x=-411kJ/mol
答:生成1mol氯化钠的反应热为-411kJ。
例2、乙醇的燃烧热△H=-1366.8kJ/mol,在25℃、101kPa时,1kg乙醇充分燃烧后放出多少热量?
解:
C2H5OH的摩尔质量是46g/mol
1kg C2H5OH的物质的量
1kg C2H5OH燃烧后放出热量=1366.8kJ/mol×21.74mol
=29714.23kJ
=2.971×104kJ
答:1kg C2H5OH燃烧后放出2.971×104kJ热量。
例3、已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ/mol
(2)C(s)+O2(g)=CO2(g) △H2=-393.5kJ/mol
(3)H2(g)+
O2(g)=H2O(l) △H3=-285.8kJ/mol
试计算下述反应的反应热:
2C(s)+2H2(g)+O2(g)=CH3COOH(l)
解:
分析各热化学方程式的关系,知道将(1)式反写(相当于逆反应,△H变号),(2)式、(3)式各乘以2,并将三者相加,即可求出上述反应的反应热。
2C(s)+2O2(g)=2CO2(g) △H2=-787.0kJ/mol
2H2(g)+O2(g)=2H2O(l) △H3=-571.6kJ/mol
+)2CO2(g)+2H2O(l)=CH3COOH(l)+2O2(g) -△H1=870.3kJ/mol
2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H=-488.3kJ/mol
答:反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的反应热为-488.3kJ/mol。
练习:
1、已知:(1)C(石墨)+
O2(g)=CO(g) △H1=-111kJ·mol-1
(2)H2(g)+
O2(g)=H2O(g) △H2=-242kJ·mol-1
(3)C(石墨)+O2(g)=CO2(g) △H3=-394kJ·mol-1
计算:(4)CO(g)+H2O(g)=CO2(g)+H2(g) △H4= ______?
解:
∵(4)=(3)-(1)-(2)
∴△H4=△H3-△H2-△H1=-41kJ·mol-1
2、现根据盖斯定律及下列热化学方程式:
P4(s,白磷)+5O2(g)=P4H10(s) △H1=-2983.2kJ·mol-1 ①
P(s,红磷)+
O2(g)=
P4H10(s) △H2=-738kJ·mol-1 ②
(1)试写出白磷转化为红磷的热化学方程式:____________________。
(2)相同状态下,能量状态较低的是______________,白磷的稳定性比红磷______________(填“高”或“低”)。
解析:
(1)根据盖斯定律,将两个热化学方程式可作如下处理:
①-②×4,得:P4(s,白磷)=4P(s,红磷) △H=?
∴△H=△H1-4×△H2
=-2983.2kJ·mol-1-(-738.0kJ·mol-1)×4
=-31.2kJ·mol-1
热化学方程式为:P4(s,白磷)=4P(s,红磷)△H=-31.2kJ·mol-1
(2)相同状态下,能量状态较低的是红磷,白磷的稳定性比红磷低。
3、已知在25℃、1.01×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,现有25℃、1.01×105Pa下的H2和CH4混合气体0.5mol,完全燃烧生成一定量的CO2和10.8g H2O(l),放出203kJ的热量,则1mol CH4完全燃烧生成CO2(g)和H2O(l)的热化学方程式为:____________________。
解析:
H2(g)+
O2(g)=H2O(l) △H=-285kJ·mol-1
x mol x mol Q1=285x kJ
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-a kJ·mol-1
y mol 2y mol Q2=ay kJ
答案:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
4、已知:胆矾溶于水时溶液温度降低,室温下将1mol硫酸铜制成溶液时放出热量为Q1 kJ·mol-1,又知胆矾分解的热化学方程式为:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l)△H=+Q2 kJ·mol-1,则Q1、Q2的关系( )
A.Q1<Q2 B.Q1>Q2
C.Q1=Q2 D.无法确定
(板书有误:此处视频中将“温度降低”误写成了“温度较低”。)
解析:
(1)CuSO4(s)=CuSO4(aq) △H1 =-Q1 kJ·mol-1
(2)CuSO4·5H2O(s)=CuSO4(s)+5H2O(l) △H2 =+Q2 kJ·mol-1
(3)CuSO4·5H2O(s)=CuSO4(aq)+5H2O(l) △H3>0
(1)+(2)=(3)
∴△H3 =△H1+△H2= Q2-Q1>0
Q2>Q1
答案:A
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -