盖斯定律告诉我们:化学反应的反应热只与反应的始态和终态有关,而与具体反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同。
(1)反应热只与反应的始态和终态有关。
反应热考查的是反应物和生成物总的“能量差”。它是一个由状态决定的量,与反应的具体途径无关。就像从同一起点登至山顶,不管选哪一条路走,我们最终跨越的是起点与终点的势能差。
(2)反应热与具体反应进行的途径无关。
下图表示的是由始态到终态的反应热。依据能量守恒定律,则△H=△H1+△H2=△H3+△H4+△H5。
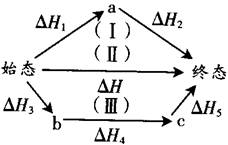
由此可见,无论反应分为几步,每步具体是什么,对整个反应的反应热都没有影响。
盖斯定律在生产和科学研究中有很重要的意义。利用已知反应的反应热,应用盖斯定律,可以间接地把某些复杂反应的反应热计算出来。另外,还可以利用已知反应的反应热去求未知反应的反应热,从而实现数据共享,避免了繁重的重复测量工作。
(1)对热化学方程式可以进行代数变换等数学处理。
根据盖斯定律,热化学方程式与数学方程式类似,可以在进行移项的同时改变正负号,各物质的化学计量数和△H的数值可以同时扩大或缩小相同的倍数。
(2)将两个或两个以上的热化学方程式(包括△H)相加或相减,得到一个新的热化学方程式。
若一个反应的热化学方程式可由另外几个反应的热化学方程式相加减而得到,则该反应的反应热亦可以由这几个反应的反应热相加减而得到。
解决此类问题的关键是善于分析各反应过程,先调整中间产物的化学计量数,再通过加减得未知反应的热化学方程式及其反应热。