1、化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
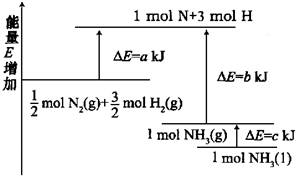
A.N2(g)+3H2(g)=2NH3(l)
△H=2(a-b-c)kJ/mol
B.N2(g)+3H2(g)=2NH3(g)
△H=2(b-a)kJ/mol
C.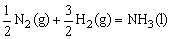
△H=(b+c-a)kJ/mol
D.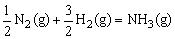
△H=(a+b)kJ/mol
2、已知Mg(s)+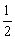 O2(g)=MgO(s) △H=Q1,2Hg(l)+O2(g)=2HgO(s) △H=Q2。现有反应Mg(s)+HgO(s)=Hg(l)+MgO(s) △H=Q3 。则Q3应为( )
O2(g)=MgO(s) △H=Q1,2Hg(l)+O2(g)=2HgO(s) △H=Q2。现有反应Mg(s)+HgO(s)=Hg(l)+MgO(s) △H=Q3 。则Q3应为( )
A.Q2-Q1 B.Q2+Q1
C.Q1-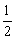 Q2 D.2Q1-Q2
Q2 D.2Q1-Q2
3、已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、1411.0kJ/mol和-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2kJ/mol B.+44.2kJ/mol
C.-330kJ/mol D.+330kJ/mol
4、氢气、一氧化碳、辛烷、甲烷的热化学方程式分别为:
H2(g)+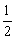 O2(g)=H2O(l)
O2(g)=H2O(l)
△H=-285.8kJ/mol
CO(g)+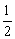 O2(g)=CO2(g)
O2(g)=CO2(g)
△H=-283.0kJ/mol
C8H18(l)+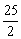 O2(g)=8CO2(g)+9H2O(l)
O2(g)=8CO2(g)+9H2O(l)
△H=-5518kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-890.3kJ/mol
相同质量的氢气、一氧化碳、辛烷、甲烷完全燃烧时,放出热量最少的是( )
A.H2(g) B.CO(g)
C.C8H18(l) D.CH4(g)
5、已知25℃、101kPa条件下:
4Al(s)+3O2(g)=2Al2O3(s)
△H=-2834.9kJ/mol
4Al(s)+2O3(g)=2Al2O3(s)
△H=-3119.1kJ/mol
则下列说法正确的是( )
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量高,由O2变O3为吸热反应
C.O2转化为O3是化学反应,但不是氧化还原反应
D.O3比O2稳定,由O2变O3为吸热反应
6、已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l)
△H=-Q1 kJ/mol
2H2(g)+O2(g)=2H2O(g)
△H=-Q2kJ/mol
2H2(g)+O2(g)=2H2O(l)
△H=-Q3kJ/mol
常温下,取体积比为4∶1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为( )
A.0.4Q1+0.05Q3 B.0.4Q1+0.05Q2
C.0.4Q1+0.1Q3 D.0.4Q1+0.1Q2
7、甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)
△H1=+49.0kJ/mol
②CH3OH(g)+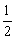 O2(g)=CO2(g)+2H2(g)
O2(g)=CO2(g)+2H2(g)
△H2=-192.9kJ/mol
下列说法正确的是( )
A.根据②推知:在25℃,101kPa时,1mol CH3OH(g)燃烧生成CO2和H2O(l)放出的热量应大于192.9kJ
B.反应②中的能量变化如图所示,则△H2=E1-E3
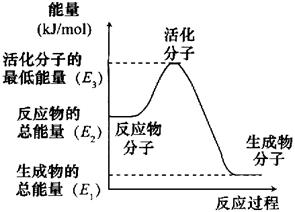
C.H2燃烧能放出大量的热,故CH3OH转变成H2的过程必须吸收能量
D.CH3OH的燃烧热△H=-192.9kJ/mol
8、已知A(g)+B(g)=C(g)△H1;D(g)+B(g)=E(g)△H2。若A和D混合气体1mol完全与B反应,放热△H3,则A和D物质的量之比是( )
A.(△H2-△H3)∶(△H1-△H3)
B.(△H3-△H2)∶(△H1-△H3)
C.(△H3-△H2)∶(△H3-△H1)
D.(△H1-△H3)∶(△H3-△H1)
9、如图所示,△H1=-393.5kJ/mol,△H2=-395.4kJ/mol,下列说法或表示式正确的是( )
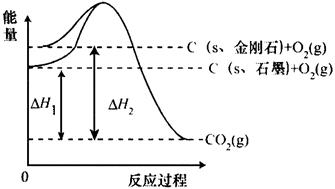
A.C(s、石墨)=C(s、金刚石)
△H=+1.9kJ/mol
B.石墨和金刚石的转化是物理变化
C.金刚石的稳定性强于石墨
D.1mol石墨的总键能比1mol金刚石的总键能小1.9kJ
10、有下列五个化学方程式(x、y、z均为正值):
①C2H2(g)+H2(g)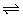 C2H4(g)
C2H4(g)
②CH4(g)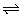 H2(g)+
H2(g)+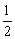 C2H4(g)
C2H4(g)
③C(s)+2H2(g)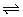 CH4(g)
CH4(g)
△H=-x kJ/mol
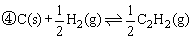
△H=-y kJ/mol
⑤C(s)+H2(g)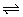
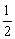 C2H4(g)
C2H4(g)
△H=-z kJ/mol
已知①为放热反应,②为吸热反应。据此判定③④⑤中关于x、y、z的大小顺序排列正确的是( )
A.x>y>z B.x>z>y
C.y>x>z D.z>x>y
11、水煤气(主要成分:CO、H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得。已知:
C(s)+H2O(g)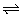 CO(g)+H2(g)
CO(g)+H2(g)
△H=+131.3kJ/mol ①
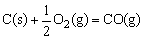
△H=-110.5kJ/mol ②
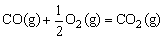
△H=-283.0kJ/mol ③
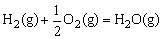
△H=-241.8kJ/mol ④
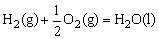
△H=-285.8kJ/mol ⑤
(1)将2.4g炭转化为水煤气,再完全燃烧,整个过程的△H=__________kJ/mol。
(2)由CO、H2在一定条件下可获得汽油的替代品——甲醇,甲醇的燃烧热为-726.5 kJ/mol,试写出由CO、H2生成甲醇的热化学方程式____________________。
显示答案
|
11、(1)-78.7
(2)CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ·mol-1 |
12、利用煤炭燃烧的反应热通常有以下两种途径:
Ⅰ.煤炭在空气中直接燃烧。
Ⅱ.先使煤与水蒸气反应得到氢气和一氧化碳,然后使氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式分别为:
Ⅰ.C(s)+O2(g)=CO2(g)
△H1(298 K)=a kJ/mol ①
Ⅱ.C(s)+H2O(g)=CO(g)+H2(g)
△H2(298 K)=b kJ/mol ②
H2(g)+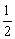 O2(g)=H2O(g)
O2(g)=H2O(g)
△H3(298 K)=c kJ/mol ③
CO(g)+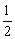 O2(g)=CO2(g)
O2(g)=CO2(g)
△H4(298 K)=d kJ/mol ④
填写以下空白:
(1)等质量的煤炭分别按以上两个不同途径反应,对产生的反应热进行比较,正确的是__________。
A.Ⅰ比Ⅱ多
B.Ⅰ比Ⅱ少
C.Ⅰ和Ⅱ在理论上相同
(2)上述四个热化学方程式中,△H>0的反应是__________。
(3)在实际应用中,途径Ⅰ与途径Ⅱ相比,哪个途径更好__________(填Ⅰ或Ⅱ),理由是________________________________________。
(4)根据能量守恒定律,△H1、△H2、△H3、△H4之间的关系为__________。
显示答案
|
12、(1)C
(2)②
(3)Ⅱ;煤的利用率高,变成气体后燃烧充分,减少了污染,运输方便,运输成本低
(4)△H1=△H2+△H3+△H4 |
13、实验中不能直接测出由石墨和氢气生成甲烷反应的△H,根据盖斯定律设计测定路线求出其△H,试从目前科研实验能力出发,设计测定步骤(要求写出或画出各步反应的转化图及计算式,各反应的反应热可用△H1、△H2……表示)。
显示答案
|
13、
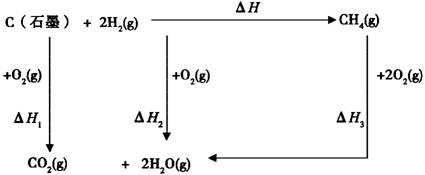
运算式:△H=△H1+△H2-△H3 |
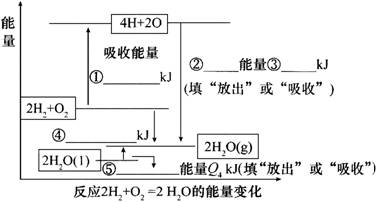
14、化学反应可视为旧键断裂和新键形成的过程。现提供H2燃烧反应中有关物质的化学键键能:H—H Q1 kJ/mol、H—O Q3 kJ/mol、O2分子内氧原子间的键能为Q2 kJ/mol。
(1)请根据上述数据,在图中标注的数字处,填出能量变化的数值或根据箭头的指向填写能量变化是“放出”热量还是“吸收”热量。
(2)请写出1mol H2燃烧生成液态水的热化学反应方程式:____________________。
显示答案
|
14、(1)①2Q1+Q2 ②放出 ③4Q3 ④4Q3-(2Q1+Q2) ⑤吸收
(2)H2(g)+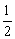 O2(g)=H2O(l) O2(g)=H2O(l)
△H=-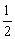 [(4Q3+Q4)-(2Q1+Q2)]kJ/mol [(4Q3+Q4)-(2Q1+Q2)]kJ/mol |
15、(1)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。下图中Ⅰ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______________________________。
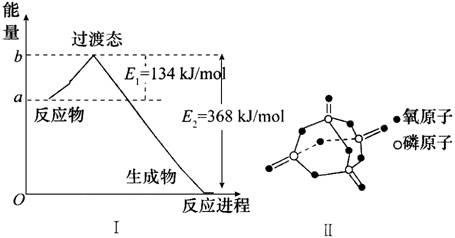
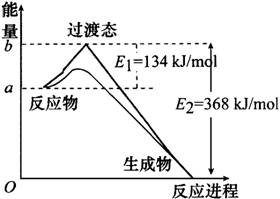
(2)请在图Ⅰ中画出使用催化剂时NO2和CO反应生成CO2和NO过程中能量变化示意图。
(3)进一步研究表明,化学反应的能量变化(△H)与反应物和生成物的键能有关。键能可以简单地理解为断开1mol化学键时所需吸收的能量。部分化学键的键能(kJ/mol)数据为:P-P:197,P-O:360,O=O:499,P=O:x。已知白磷分子为P4,是正四面体型分子,P4(s)+5O2(g)=2P2O5(s);其燃烧热为2378.0kJ/mol,白磷完全燃烧的产物结构如图Ⅱ所示,则x=__________。
显示答案
|
15、(1)NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)
(3)433.75 |