| 影响化学反应速率的因素 |
主编:黄冈中学化学集体备课组
(讲)前面我们学习了化学反应速率,知道了化学反应速率主要由反应本身决定,但也受外界条件影响。
一、外界条件对反应速率的影响
实验1:
取两支试管,各加入4 mL 0.01 mol/L的KMnO4酸性溶液,然后向一支试管中加入0.1 mol/L H2C2O4(草酸)溶液2 mL,记录溶液褪色所需的时间;向另一支试管中加入0.2 mol/L H2C2O4溶液2 mL,记录溶液褪色所需的时间。
实验中发生了如下反应:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
加入试剂
0.1 mol/L H2C2O4溶液
0.2 mol/L H2C2O4溶液
实验现象
褪色时间
结论
结论:浓度对化学反应速率的影响:增大反应物浓度,可增大化学反应速率。
实验2:
取两支试管各加入5 mL 0.1 mol/L Na2S2O3;另取两支试管各加入5 mL 0.1 mol/L H2SO4;将四支试管分成两组(各有一支盛有Na2S2O3和H2SO4的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合并搅拌。记录出现浑浊的时间。
实验中反应的化学方程式为:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
试剂种类及用量
0.1 mol/L Na2S2O3 5mL
0.1 mol/L H2SO4 5mL
0.1 mol/L Na2S2O3 5mL
0.1 mol/L H2SO4 5mL
实验温度
出现浑浊时间
结论
结论:温度对化学反应速率的影响:升高温度,可以增大化学反应速率。
实验3:
实验装置如图所示,锥形瓶内盛有10 mL左右10%的H2O2,双孔胶塞上插有短导管和漏斗,短导管里插有带余烬的木条。开始时余烬没有明显变化,经漏斗向锥形瓶内加入少量MnO2后,试管中迅速产生大量气泡,余烬复燃。
科学探究:
在两支试管中分别加入2mL 5% H2O2溶液,再向H2O2溶液中分别滴入0.1mol/ L FeCl3和CuSO4溶液各1 mL,摇匀,比较H2O2的分解速率。
加入试剂
0.1mol/ L FeCl3
0.1mol/ L CuSO4
产生气泡快慢
结论
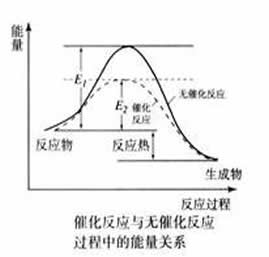
结论:催化剂的影响:加入催化剂,反应的速率增大。
(讲)压强对化学反应速率的影响:对于有气体参与(或生成)的化学反应,增大压强,可增大反应速率。
为什么改变这些外界条件可以加快反应速率呢?如何从微观的角度解释?我们要介绍一种研究化学反应过程教学模型。
二、有效碰撞与活化分子
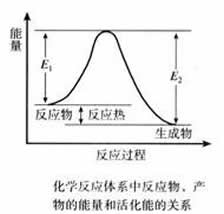
(讲)化学反应的本质是反应物分子中化学键的断裂,生成物分子中化学键的形成过程。旧键的断裂和新键的形成都是通过反应物分子(或离子)的相互碰撞来实现的。如果反应物的分子(或离子)相互不碰撞、不接触,就不可能发生化学反应。因此,反应物分子(或离子)间的碰撞是反应发生的必要条件。但反应物的分子每次碰撞不一定都能发生化学反应,能够发生化学反应的碰撞叫有效碰撞。
有效碰撞:能够发生化学反应的碰撞。
活化分子:能够发生有效碰撞的分子。
(讲)有效碰撞必须具备的条件:①发生碰撞的分子必须具备一定的能量(即活化分子)。②碰撞时必须有合适的取向。
(类比投篮)运动员没有提供足够的能量,球不能投进篮筐,球具有足够的能量,但没有合适的取向;球具有足够的能量与合适的取向,球投进篮筐。即分子具备一定的能量与合适的取向才能发生化学反应。
活化能:活化分子的能量与反应物分子平均能量之差叫活化能。
E1:正反应活化能
E2:逆反应活化能
活化能的大小意味着一般分子成为活化分子的难易,但对反应热无影响。
不同的化学反应所需活化能的差别很大,通常只能用实验方法测得,并以测量温度对反应速率的影响为主要方法,温度对某反应速率的影响程度,大致反映了该反应活化能的大小。
三、有效碰撞理论解释外因对反应速率的影响
变化结果
条件变化
单位体积
分子总数
单位体积
活化分子数
活化分子
百分数
有效碰撞
次数
反应速率
增加反应物的浓度
增多
增多
不变
增多
加快
增大压强
增多
增多
不变
增多
加快
升高温度
不变
增多
增多
增多
加快
使用催化剂
不变
增多
增多
增多
加快
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -