|
一、选择题
1、决定化学反应速率的根本因素是( )
A.温度和压强
B.反应物的浓度
C.参加反应的各物质的性质
D.催化剂的加入
2、一定温度下,在固定体积的密闭容器中发生下列反应:2HI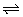 H2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为( ) H2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为( )
A.等于5s B.等于10s
C.大于10s D.小于10s
3、0.1mol·L-1 Na2S2O3溶液与0.1mol·L-1 H2SO4溶液各5mL和10mL水混合,反应速率为v1 mol·L-1·s-1;0.2mol·L-1 Na2S2O3溶液与0.2mol·L-1 H2SO4溶液各5mL和20mL水混合,反应速率为v2 mol·L-1·s-1,则v1和v2的关系是( )
A.v1>v2 B.v1<v2
C.v1=v2 D.不能确定
4、在带有活塞的密闭容器中发生反应:Fe2O3+3H2=2Fe+3H2O,采取下列措施不能改变反应速率的是( )
A.增加Fe2O3的量
B.保持容器体积不变,增加H2输入量
C.充入N2,保持容器内压强不变
D.充入N2,保持容器内体积不变
5、下列说法中正确的是( )
A.0.1mol·L-1 HCl和0.1mol·L-1 H2SO4分别与2mol·L-1 NaOH溶液反应,反应速率相同
B.大理石块与大理石粉分别同0.1mol·L-1盐酸反应,反应速率相同
C.Mg和Fe在相同条件下分别与0.1mol·L-1盐酸反应,其反应速率相同
D.0.1mol·L-1 HCl和0.1mol·L-1 HNO3分别与相同形状和大小的大理石反应,速率相同
6、一定量的锌粉和6mol·L-1的过量盐酸反应,当向其中加入少量的下列物质时,既能够加快反应速率,又不影响产生H2总量的是( )
①石墨 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥无水乙酸
A.①③④ B.①③⑤
C.②④⑥ D.②⑤⑥
7、某学生用纯净的Cu与过量浓HNO3反应制取NO2,实验结果如图所示,下列对图中曲线的描述正确的是( )
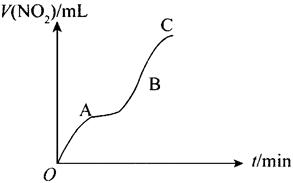
A.OA段表示开始时反应速率稍慢
B.AB段表示反应速率较快,可能因为产物有催化作用
C.BC段表示反应速率最快,在该时间内收集到的气体最多
D.OC线表示随时问增加,反应速率逐渐增大
8、在有气体参与的反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )
①增大反应物的浓度 ②升高温度 ③增大压强 ④移去生成物 ⑤加入催化剂
A.①②③ B.①②③⑤
C.②⑤ D.①②③④⑥
9、反应E+F→G在温度T1下进行,反应M+N→K在温度T2下进行,已知T1>T2;且E和F的浓度均大于M和N的浓度(其他条件均相同),则两者的反应速率( )
A.前者大 B.后者大
C.一样大 D.无法判断
10、把下列四种X溶液分别加入四个盛有10mL 2mol·L-1盐酸的烧杯中,均加水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃ 20mL 3mol·L-1的X溶液
B.20℃ 30mL 2mol·L-1的X溶液
C.20℃ 10mL 4mol·L-1的X溶液
D.10℃ 10mL 2mol·L-1的X溶液
二、填空题
11、已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速率v和反应时间t的关系如图所示。
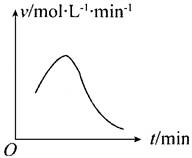
已知这个反应的反应速率随溶液中氢离子浓度增大而加快,试解释:
(1)反应开始后,反应速率加快的原因是______________________________。
(2)反应后期,反应速率下降的原因是______________________________。
显示答案
|
11、(1)开始时,随着反应的进行,不断有强酸H2SO4生成,c(H+)不断增大,反应速率也随之加快
(2)随着时间的延长,KClO3和NaHSO3被消耗而愈来愈少,浓度愈来愈小,因此反应速率下降 |
12、亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式是:
5Na2SO3+2KIO3+H2SO4=2Na2SO4+K2SO4+I2+H2O
(1)其中氧化剂是__________,若反应中有5mol电子转移,则生成碘是__________mol。
该反应过程和机理较复杂,一般认为分为以下几步:
①IO3-+SO32-=IO2-+SO42-(慢)
②IO2-+SO32-=IO-+SO42-(快)
③5I-+6H++IO3-=3I2+3H2O(快)
④I2+SO32-+H2O=2I-+SO42-+2H+(快)
(2)根据上述条件推测,此反应的总的反应速率由__________步反应决定。
(3)若预先加入淀粉溶液,由题述看,必在__________离子消耗完时,才会使淀粉变蓝的现象产生。
显示答案
|
12、(1)KIO3;0.5
(2)①
(3)SO32- |
13、“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
实验编号 |
① |
② |
③ |
④ |
⑤ |
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
t/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是______________________________。
(2)显色时间t2=__________。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为__________(填字母)。
A.<22.0s B.22.0~44.0s
C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是____________________。
显示答案
|
13、(1)研究反应物I-与S2O82-的浓度对反应速率的影响
(2)29.3s
(3)A
(4)反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比)
解析:
(2)分析所给数据,可以得出显色时间与c(I-)·c(S2O82-)数值成反比,利用①、⑤两组数据,可知两组实验中c(S2O82-)相同,而c(I-)⑤是①的3倍,因此⑤所用显色时间是①的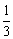 ,即 ,即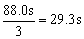 。 。
(3)在反应物起始浓度相同的条件下,温度越高,反应速率越快,则显色时间越短。故选A。 |
14、用如图所示装置进行如下实验:
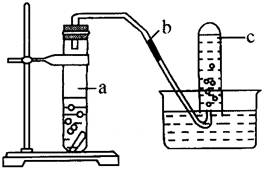
(1)在检验装置气密性后,向试管a中加入10mL 6mol·L-1的稀硝酸和1g铜片,立即用橡皮塞塞紧试管口。请写出在试管a中有可能发生的所有反应的化学方程式____________________。
(2)在实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于________________,当反应进行一段时间后速率又逐渐减小,原因是____________________。
(3)欲较快地制得NO,可采取的措施是__________(填写字母序号)。
A.加热
B.使用铜粉
C.稀释HNO3
D.增大硝酸的浓度
显示答案
|
14、(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;2NO+O2=2NO2
(2)开始时,速率缓慢,后随反应进行,反应放热,溶液温度升高是影响化学反应速率的主要因素,故反应速率加快。
反应一段时间后,HNO3的浓度降低是影响化学反应速率的主要因素,故反应速率又逐渐减小。
(3)AB |
|