化学平衡常理解与应用
①对于一般的可逆反应:mA(g)+nB(g)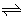 pC(g)+qD(g),其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数公式可以表示为:
pC(g)+qD(g),其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数公式可以表示为: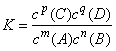 ,各物质的浓度一定是平衡时的浓度,而不是其他时刻的。
,各物质的浓度一定是平衡时的浓度,而不是其他时刻的。
②在进行K值的计算时,固体和纯液体的浓度可视为“1”。
例如:Fe3O4(s)+4H2(g) 3Fe(s)+4H2O(g),在一定温度下,化学平衡常数
3Fe(s)+4H2O(g),在一定温度下,化学平衡常数 。
。
③利用K值可判断某状态是否处于平衡状态。
例如,在某温度下,可逆反应mA(g)+nB(g)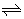 pC(g)+qD(g),平衡常数为K。若某时刻时,反应物和生成物的浓度关系如下:
pC(g)+qD(g),平衡常数为K。若某时刻时,反应物和生成物的浓度关系如下: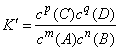 ,则有以下结论:
,则有以下结论:
K′=K,V(正)=V(逆),可逆反应处于化学平衡状态;
K′<K,V(正)>V(逆),可逆反应向正反应方向进行;
K′>K,V(正)<V(逆),可逆反应向逆反应方向进行。
④化学平衡常数是指某一具体化学反应的平衡常数,当化学反应方程式的计量数增倍或减倍时,化学平衡常数也相应的发生变化。