| 影响化学平衡的条件(浓度) |
主编:黄冈中学化学集体备课组
(讲)一定条件下,一个可逆反应进行到v正=v逆最大限度,这时我们称这个可逆反应在该条件下达到化学平衡状态。如果条件不改变,可逆反应将一直维持在这个平衡状态不变。
(板书)
一定条件下的化学平衡平衡破坏新条件下化学平衡
v正=v逆
v正≠v逆
v正′= v逆′
各组分的浓度一定各组分的浓度又保持新的一定
(Ⅰ)(Ⅱ)
(讲)如果达到平衡状态后,条件改变,使得v正≠v逆,原来的化学平衡状态被破坏了。但经过一段时间后,又会使得v正′=v逆′,建立新条件下的平衡,各组分的浓度又保持新的一定。
(讲)可逆反应从一个化学平衡状态变到另一个化学平衡状态的过程,就叫做化学平衡的移动,又叫做旧化学平衡被破坏,新化学平衡建立的过程。
一、化学平衡移动
(讲)移动应该有方向,化学平衡移动的方向由条件改变的这一瞬时,处于主导地位的反应方向决定。即改变的这一瞬时,v正′与 v逆′的大小决定。
v正′>v逆′平衡正向移动
v正′<v逆′平衡逆向移动
v正′= v逆′平衡不移动
二、影响化学平衡移动的因素
浓度对化学平衡的影响
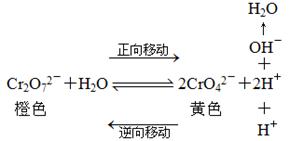
实验1:
已知在K2Cr2O7的溶液中存在着如下平衡:
K2Cr2O7为橙色,K2CrO4为黄色。
取两支试管各加入5mL 0.1mol/L K2Cr2O7溶液,然后按下表步骤操作,观察并记录溶液颜色的变化。
编号
1
2
步骤
滴加3~10滴浓H2SO4
滴加10~20滴6mol/L NaOH
K2Cr2O7溶液
分析:
实验2:
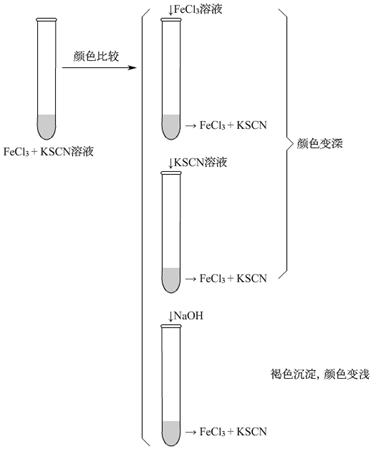
向盛有5mL 0.005mol/ L FeCl3溶液的试管中加入5mL 0.01mol/ L KSCN溶液,溶液呈红色。在这个反应体系中存在下述平衡:
Fe3++3SCN-
Fe(SCN)3
(红色)
(1)将上述溶液均分置于两支试管中;向其中一支试管中加入饱和FeCl3溶液4滴,充分振荡,观察溶液颜色变化;向另一支试管中滴加4滴1 mol/ L KSCN溶液,观察溶液颜色变化。
(2)向上述两支试管中各滴加0.01 mol/ L NaOH溶液3~5滴,观察现象,填写下表。
编号
1
2
步骤(1)
滴加饱和FeCl3溶液
滴加1 mol/L KSCN溶液
现象
步骤(2)
滴加NaOH溶液
滴加NaOH溶液
现象
结论
分析:
Fe3++3SCN-
Fe(SCN)3
归纳出结论:其它条件不变时,增大反应物的浓度或减小生成物的浓度,可使平衡正向移动,反之,平衡逆向移动。
从化学平衡常数的角度解释原因。
(副版)T℃,一定条件下,2SO2+O2
2SO3达到化学平衡状态,
2SO2 + O2
2SO3
平衡(mol·L-1) a b c
其它外界条件不变达平衡后,再通入过量的O2,使得c(O2)′=2b,假设加进去的瞬时就达到平衡了,则此时
,而平衡常数仅与温度有关。而温度不变,平衡常数是不变的,平衡正向移动。
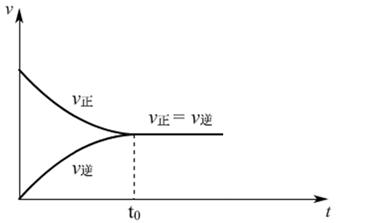
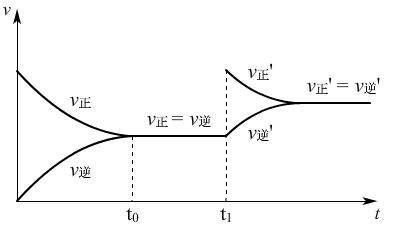
例、工业合成SO3,最开始投入SO2、O2,反应时进行到t0时,达到平衡状态,v-t图如下:
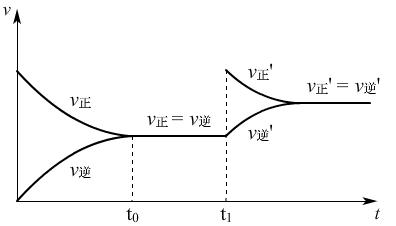
①t1时,增大c(O2),v-t图:
分析:
增大c(O2),加入O2的瞬间V正增大,V逆不变,随着反应的进行,使得V正减小,V逆增大,最终V正′=V逆′,且物质的量浓度增大,反应速率变大,V正′=V逆′。
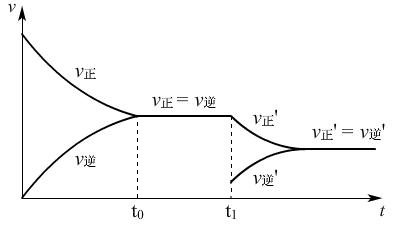
②t1时,增大c(SO2),v-t图:
分析:
增大c(SO2),加入SO2的瞬间V正增大,V逆不变,随着反应的进行,使得V正减小,V逆增大,最终V正′=V逆′,且物质的量浓度增大,反应速率变大,V正′=V逆′。
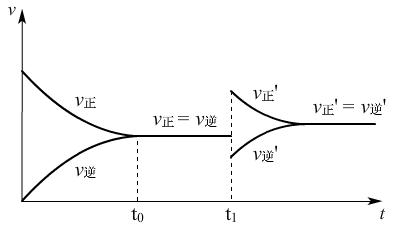
③t1时,减小c(SO3),v-t图:
物质的量浓度减小了,反应速率比原来减小。
④t1时,减小c(O2),v-t图:
(讲)单一改变反应物或生成物浓度时,都与原来的v-t图有交点,而实际生产中,通常不是这样简单的单一操作。
(提问)实际生产中,增加c(O2),及时移走生成的SO3,c(SO3)减小,假设在t1时,这样操作,v-t图如何?
⑤增加c(O2),减小c(SO3),v-t图:
(提问)平衡线在原来的上面还是下面,还是可能保持不变。(都有可能,与V正′与V逆′的变化程度有关)
工业上生产SO3,采用通入过量的空气,以及及时将生成的SO3移走,这样做有两个好处:
①增大反应物浓度,减小生成物浓度,平衡正向移动,生成更多的SO3。
②提高SO2的转化率。
(讲)对于可逆反应,增大一种反应物的浓度,可以提高另一种反应物的转化率,而它自身的转化率降低,工业上利用这个原理,常常适当增大廉价反应物的浓度,提高价格较高的原料的转化率,降低成本。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -