例1、(全国卷I)下图表示反应X(g) 4Y(g)+Z(g);△H<0,在某温度时X的浓度随时间变化曲线:
4Y(g)+Z(g);△H<0,在某温度时X的浓度随时间变化曲线:
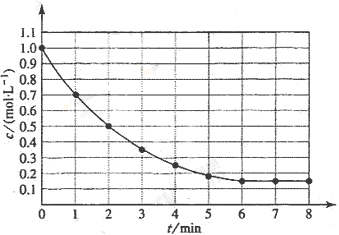
下列有关该反应的描述正确的是( )
A.第6min后,反应就终止了
B.X的平均转化率为85%
C.若升高温度,X的平均转化率将大于85%
D.若降低温度,v正和v逆将以同样倍数减小
 解析:
解析:
A项,6min时反应达平衡,但未停止,故A错;B项,X的变化量为1-0.15=0.85mol,转化率为0.85/1=85%,正确。△H<0,正反应为放热,故升高温度,平衡将逆向移动,则X的转化率减小,C项错;D项,降温,正、逆反应速率同时减小,但是降温平衡正向移动,故V正>V逆,即逆反应减小的倍数大,D错误。
答案:B
例2、(四川)在一体积可变的密闭容器中,加入一定量的X、Y,发生反应

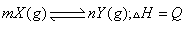 kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气
 体体积的关系如下表所示:
体体积的关系如下表所示:
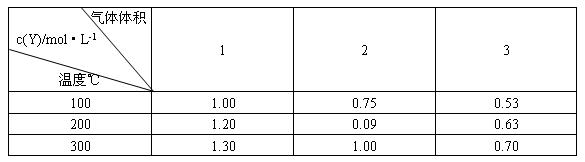
下列说法正确的是( )
 A.m>n
A.m>n
 B.Q<0
B.Q<0
 C.温度不变,压强增大,Y的质量分数减少
C.温度不变,压强增大,Y的质量分数减少
 D.体积不变,温度升高,平衡向逆反应方向移动
D.体积不变,温度升高,平衡向逆反应方向移动
解析:
根据题目信息可得,在温度相同的条件下,当体积扩大到原来的两倍时,Y的浓度降低的倍数小于2,所以可确定增大体积,平衡正向移动,根据平衡移动原理,增大体积,平衡向体积增大的方向移动,因此A错误,C项正确。当体积相同时,温度升高,Y的浓度增大,即平衡向右移动,所以正反应为吸热反应,B、D错误。
答案:C
例3、(重庆)各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )
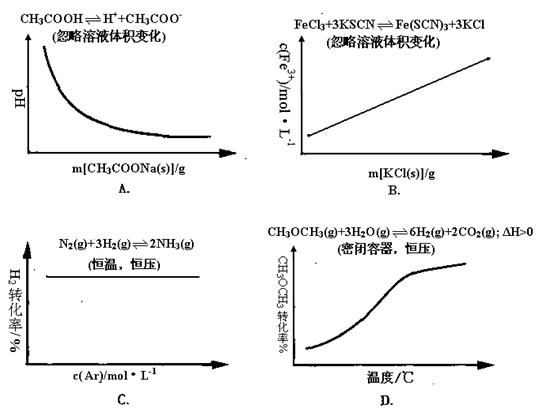
解析:
A项CH3COOH溶液中加入CH3COONa固体,CH3COOH溶液中CH3COO-浓度增加,电离平衡向左移动,c(H+)减小,pH逐渐增大,A错误;B项加入KCl对平衡体系无影响,化学平衡不移动,B错误;C项恒温恒压,加入Ar,各反应物的物质的量不变,体积变大,各物质的量浓度成倍减小(等效于减压),化学平衡向体积增大方向移动,H2的改变量减小,起始量不变,转化率减小,C错误。
答案:D
例4、(全国卷二)已知反应A2(g)+2B2(g)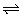 2AB2(g)的△H<0,下列说法正确的是( )
2AB2(g)的△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
答案:B
A2(g)+2B2(g)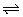 2AB2(g),△H<0,则说明正反应为放热反应。升高温度,正、逆反应速率都增大,达到平衡的时间缩短;A错B对;升高温度平衡向逆向移动,增大压强平衡向正向移动,相反降低温度平衡向正向进行,减小压强平衡向逆向进行,故答案为B。
2AB2(g),△H<0,则说明正反应为放热反应。升高温度,正、逆反应速率都增大,达到平衡的时间缩短;A错B对;升高温度平衡向逆向移动,增大压强平衡向正向移动,相反降低温度平衡向正向进行,减小压强平衡向逆向进行,故答案为B。
例5、(广东)在一定条件下,固定容积的密闭容器中反应:2NO2(g)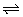 O2(g)+2NO(g); △H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
O2(g)+2NO(g); △H>0,达到平衡。当改变其中一个条件X,Y随X的变化符合图中曲线的是( )
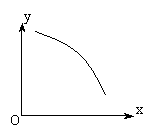
A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量
答案:AB