| 影响化学平衡的条件(温度和催化剂) |
主编:黄冈中学化学集体备课组
一、温度对化学平衡的影响
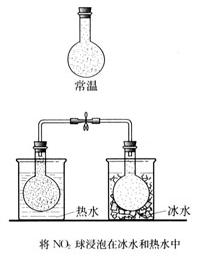
(板书)2NO2(g)
N2O4(g) △H<0 正反应为放热反应
红棕色 无色
(演示实验)
在其它条件不变时,升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
对反应2NO2(g)
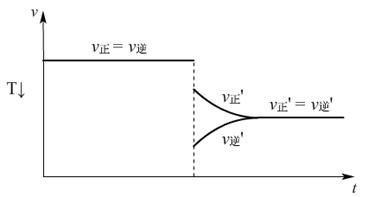
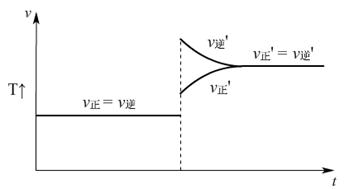
N2O4(g) △H<0,达到平衡后,改变温度,v-t图:
降低温度
升高温度
(讲)无论是吸热反应还是放热反应,升高温度,反应速率加快,达到平衡所需的时间缩短;降低温度,反应速率减慢,达到平衡所需时间延长。
(讲)浓度和压强对化学平衡的影响,是因为浓度或压强的改变使得体系中各组分的百分含量改变了,使得平衡移动,而温度对化学平衡的影响,是因为平衡常数改变了,而使平衡移动。
(讲)浓度、压强、温度对化学平衡的影响可以概括为平衡移动原理——勒夏特列原理。
勒夏特列原理:如果改变影响化学平衡的一个条件,平衡将向着减弱这种改变的方向移动。
(副版)Fe3++3SCN-
Fe(SCN)3
c(Fe3+)增大→减弱c(Fe3+)增大,即要消耗Fe3+,也就是正反应方向,但最后再次达平衡时c(Fe3+)比原平衡还是要大。
条件改变
平衡移动方向
平衡移动结果
增大反应物浓度
正向移动
反应物浓度减小,但比原平衡时反应物浓度大
减小生成物浓度
正向移动
生成物浓度增大,但比原平衡时生成物浓度小
升高温度
向吸热反应方向移动
体系温度降低,但比原平衡时体系温度高
增大压强
向气体物质的量减小的方向移动
体系压强减小,但比原平衡时体系压强大
二、催化剂对化学平衡移动没有影响
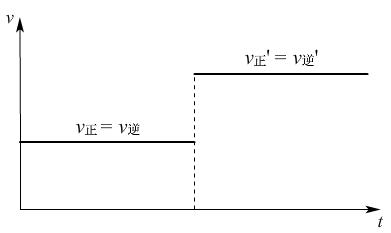
催化剂能同等程度的改变正逆反应速率,平衡不移动,也就是说使用催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂反应速率增大,能缩短达到平衡的时间。
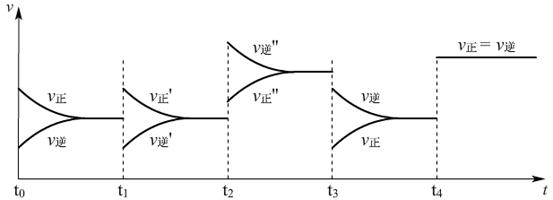
思考题:下图是合成氨时的v-t图,N2+3H2
2NH3 △H<0
(1)t0时反应从哪方开始?向哪个方向移动?(正逆反应同时开始,向正反应方向移动)
(2)t1、t2、t3、t4 时刻分别改变了什么条件?平衡移动方向怎样?
t1时,增大反应物的浓度,同时又减小生成物的浓度,平衡正向移动。
t2时,升高温度,平衡逆向移动。
t3时,减小压强,平衡逆向移动。
t4时,加入催化剂,平衡不移动。
高一全科点睛班课程 高一全科强化班课程 高二全科全年强化班 高三全科强化班课程 初一全科强化班课程 初一全科点睛班课程 初二全科强化班视频 初二全科点睛班课程 初三全科强化班 全科巨无霸同步提高课程 小学全年全科强化班
- 返回 -