1、下列事实不能用化学平衡移动原理解释的是( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.增大压强,有利于SO2和O2反应生成SO3
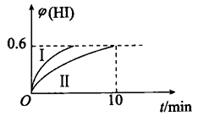
2、将1molI2(g)和2 mol H2(g)置于2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)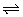 2HI(g) △H<0。10 min后达到平衡,HI的体积分数
2HI(g) △H<0。10 min后达到平衡,HI的体积分数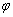 (HI)随时间的变化如曲线Ⅱ所示。若改变反应条件,
(HI)随时间的变化如曲线Ⅱ所示。若改变反应条件,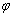 (HI)的变化如曲线I所示,则该条件可能是( )
(HI)的变化如曲线I所示,则该条件可能是( )
A.恒容条件下升高温度
B.恒温恒容条件下加入适当的催化剂
c.恒温条件下扩大反应容器的体积
D.增大反应物中H2的浓度
3、如图所示,曲线a表示放热反应X(g)+Y(g)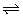 Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
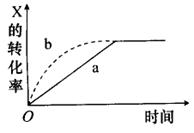
A.升高温度 B.加大X的投入量
C.加催化剂 D.增大体积
4、已知反应:C(s)+CO2(g)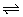 2CO(g) △H>0,该反应达到平衡后,下列条件有利于反应向正反应方向进行的是( )
2CO(g) △H>0,该反应达到平衡后,下列条件有利于反应向正反应方向进行的是( )
A.升高温度和减小压强 B.降低温度和减小压强
C.降低温度和增大压强 D.升高温度和增大压强
5、可逆反应口X(g)+bY(g)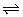 cZ(g)在一定温度下,达到平衡状态,t0时改变某一外界条件,其速率一时间图象如图所示。则下列说法不正确的是( )
cZ(g)在一定温度下,达到平衡状态,t0时改变某一外界条件,其速率一时间图象如图所示。则下列说法不正确的是( )
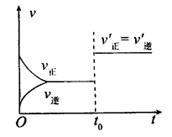
A.改变的条件可能为缩小反应容器的体积
B.改变条件后平衡一定没发生移动
C.改变的条件可能为升高温度
D.改变的条件可能为加入催化剂
6、已知反应N2(g)+3H2(g)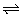 2NH3(g) △H<0,向某体积恒定的密闭容器中按体积比1︰3充入N2和H2,在一定条件下发生反应。下图是某物理量(y)随时间(t)变化的示意图,y可以是( )
2NH3(g) △H<0,向某体积恒定的密闭容器中按体积比1︰3充入N2和H2,在一定条件下发生反应。下图是某物理量(y)随时间(t)变化的示意图,y可以是( )
A.N2的转化率 B.混合气体的密度
C.密闭容器的压强 D.H2的体积分数
7、已知可逆反应aA(g)+bB(g)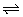 cC(g)中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
cC(g)中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是( )
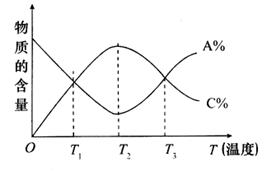
A.该反应在T1、T3温度时达到过化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
8、在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g)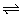 H2(g)+I2(g) △H>0,在t1时达到平衡,t2时加热升温,到t2时又达到新平衡,符合这一变化的图象是( )
H2(g)+I2(g) △H>0,在t1时达到平衡,t2时加热升温,到t2时又达到新平衡,符合这一变化的图象是( )
9、在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:CO(g)+H2O(g)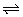 CO2(g)+H2(g),达到平衡后,测得CO2为0.6 mol,再通入4 mol水蒸气,又达到平衡后,CO2的物质的量为( )
CO2(g)+H2(g),达到平衡后,测得CO2为0.6 mol,再通入4 mol水蒸气,又达到平衡后,CO2的物质的量为( )
A.等于0.6 mol B.等于1mol
C.大于0.6 mol,小于1mol D.大于1 mol
10、已知可逆反应aA(g)+bB(?)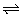 cC(g)△H>0(B物质的状态未确定)。关于该反应的描述正确的是( )
cC(g)△H>0(B物质的状态未确定)。关于该反应的描述正确的是( )
A.加压若平衡正向移动,则a>c
B.加入一定量的B,平衡一定正向移动
C.缩小容器的体积,各物质的浓度一定增大
D.升高温度,平衡一定正向移动,混合气体的平均摩尔质量的变化不能确定
11、反应mA+nB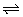 pC在某温度下达到平衡状态。
pC在某温度下达到平衡状态。
(1)若升高温度,A物质的转化率增大,该反应为___________反应。
(2)若C为气体,且m+n=p,在加压时化学平衡发生移动,则平衡必定向___________方向移动。
(3)如果在体系中增加或减小B的量,平衡均不发生移动,则B肯定不能为___________态。
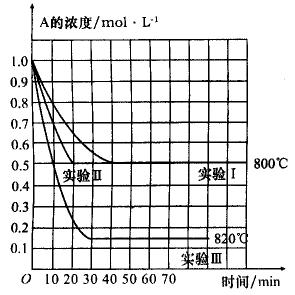
12、在一恒温密闭容器中,某化学反应2A(g)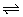 B(g)+C(g)在三种不同条件下进行,其中实验I、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
B(g)+C(g)在三种不同条件下进行,其中实验I、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol·L-1)随时间(min)的变化如图所示:
请回答:
(1)在实验I中,反应在20 min至30 min内A的平均反应速率为___________mol·L-1·min-1。
(2)把实验Ⅱ和实验Ⅰ比较,隐含的条件是___________。
(3)根据实验Ⅲ和实验I比较,可推测该反应升高温度,平衡向___________(“正”或“逆”)反应方向移动,该正反应是___________(“放热”或“吸热”)反应。
(4)与实验I比较,若将实验I中A的起始浓度改为1.2 mol·L-1,其他条件不变,则达到平衡时,所用时间___________实验I(填“>”“<”或“无法确定”)。