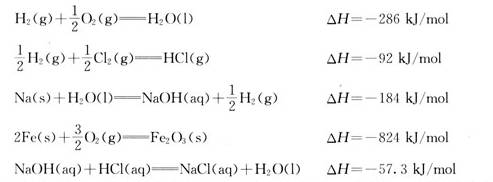| 化学反应进行的方向 |
主编:黄冈中学化学集体备课组
(引)汽车尾气中的主要污染物NO以及燃料不完全燃烧所产生的CO,它们是现代城市中的大气污染物,为了减轻大气污染,人们通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)=N2(g)+2CO2(g),你能否判断这一方案是否可行?理论依据是什么?
上述问题是化学反应的方向的问题,反应进行的方向、快慢和限度是化学反应原理的三个重要组成部分。这节课我们主要来讨论反应的方向的问题。
(板书)化学反应进行的方向
(讲)在我们讨论问题之前,先来说两个概念,自发过程和自发反应
一、自发过程和自发反应
1、自发过程:在一定条件下,不需要外力就能自动进行的过程。
生活中的自发过程很多,如:水由高处往底处流,自由落体运动,电流由电位高的地方向电位低的地方流,铁器暴露于潮湿的空气会生锈,室温下冰块会融化……这些都是自发过程。
2、自发反应:在一定条件下,能自发地进行到显著程度的反应。
自发过程各自发反应可被利用来完成有用功。如向下流动的水可推动机器,甲烷燃烧可在内燃机中被利用来做功,锌与CuSO4溶液的反应可被设计成原电池。如果一个过程是自发的,则其逆过程是非自发的。非自发的过程要想发生,则必须对它做功,如利用水泵可将水从低处流向高处,通电可将水分解成H2和O2。
人们在日常生活中长期积累的经验表明,那些不用借助于外力就可以自动进行的自发过程都是体系趋向从高能状态转化为低能状态。从学习化学的经验告诉我们,在化学反应中,放热反应常常是容易发生的。如:
放热反应过程使体系能量降低,因此具有自发进行的倾向,科学家由此提出用焓变来判断反应进行的方向,即反应方向的焓判据。
二、反应方向的焓判据
焓判据:放热过程中体系能是降低,具有自发进行的倾向。
(讲)多数自发进行的化学反应是放热反应,但也有不少吸热反应能自发进行。如:
还有一些吸热反应在室温条件下不能自发进行,但在较高温度下可自发进行。
如:CaCO3
CaO+CO2↑
因此,反应焓变是反应能否自发进行的一个有关因素,但并不是唯一因素。
(讲)科学家注意到,还有一类自发过程,与能量变化无关,如放在同一密闭容器中的不同气态物质,会通过分子的扩散自发地形成均匀的混合物。物质溶于水自发地向水中扩散,形成均一稳定的溶液。
为了解释这一类与能量无关过程的自发性,科学家提出了另一推动体系变化的因素:在密闭条件下,体系有由“有序”变为“无序”的倾向。因为与有序体系相比,“无序体系”更加稳定,可以采取更多地存在方式。以扑克牌为例,经过多次的洗牌之后,严格按照花色和序号排列的机会与花色序号毫无规律的混乱排列的机会相比,大概要相差几十个数量级。
三、反应方向的熵判据
(讲)科学家用熵来界定这种混乱(无序)的程度,据此,提出了:
1、熵:用来表示混乱度的状态函数,用符号S表示,熵越大,体系的混乱度越大,越无序。
2、熵判据:密闭条件下,体系有序自发地变为无序的倾向,即熵增加的过程具有自发进行的倾向。
3、熵的大小判断
(1)同一物质:气态>液态>固态
(2)与物质的量成正比
如:2mol O2的熵值>1mol O2的熵值
4、反应熵变
有气体生成的反应及气体的物质的量增加的反应为熵增加的反应。
(注意:两种气体的混合也是熵增加的过程)
反应熵变△S=产物总熵-反应物总熵
△S>0,为熵增加的反应;△S<0,为熵减小的反应;
有些熵减小的反应在一定条件下也可以自发进行,如:
-10℃的液态水会自动结冰成为固态,就是熵减的过程(但它是放热的);
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) △S=-39.35J·mol-1·K-1。
因此,反应熵变是与反应能否自发进行有关的又一个因素,但也不是唯一因素。
(过渡)反应方向是由焓变与熵变共同决定的。
(板书)
四、焓变与熵变对反应方向的共同影响
在一定条件下,一个化学反应能否自发进行,既与反应焓变有关,又与反应熵变有关。研究表明,在恒温、恒压下,判断化学反应自发性的判据是:
(板书)体系自由能(吉布斯自由能)变化(△G、单位:kJ/mol):
(T为热力学温度,单位:开尔文)
△G=△H-T△S(吉布斯——亥姆霍兹公式)
体系自由能变化综合考虑了焓变和熵变对体系的影响。
(板书)△G=△H-T△S<0 反应能自发进行;
△G=△H-T△S=0 反应达到平衡状态;
△G=△H-T△S>0 反应不能自发进行。
类型 |
△H |
△S |
△G及反应方向 |
反应实例 |
1 |
-,焓减 |
+,熵增 |
-,任何温度下均自发,自由能减少 |
2H2O2(l)=2H2O(l)+O2(l) |
2 |
+,焓增 |
-,熵减 |
+,任何温度均不自发,自由能增加 |
3O2(g)=2O3(g) |
3 |
-,焓减 |
-,熵减 |
-,低温自发,+,高温不自发 |
N2(g)+3H2(g)=2NH3(g) |
4 |
+,焓增 |
+,熵增 |
+,低温不自发,-,高温自发 |
CaCO3 |
例:处理汽车尾气的反应:2NO(g)+2CO(g)=N2(g)+2CO2(g),
298K,101kPa时,△H=-113.0kJ·mol-1
△S=-143.5J·mol·K-1
△G=△H-T·△S=-69.68kJ·mol-1<0
室温下该反应能自发进行,但反应速率很慢,基本上等于没有发生,无法应用于实际,用催化剂,极大的加快了反应速率。
总结:在这里我们还要注意的是,大量事实告诉我们,过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率。例如,涂有防锈漆和未涂防锈漆的钢制器材,其发生腐蚀过程的自发性是相同的,但是只有后者可以实现。
在讨论过程的方向问题时,我们指的是没有外界干扰时体系的性质;如果允许外界对体系施加某种作用,就可以出现相反的结果。
年级 |
课程名称 |
免费听课 |
课程详情 |
| 高一全科点睛班课程 |
|||
| 高一全科强化班课程 | |||
| 高二全科全年强化班 |
|||
| 高三全科强化班课程 |
|||
| 初一全科强化班课程 | |||
| 初一全科点睛班课程 | |||
| 初二全科强化班视频 |
|||
| 初二全科点睛班课程 |
|||
| 初三全科强化班 |
|||
| 全科巨无霸同步提高课程 | |||
| 小学全年全科强化班 |
|||
- 返回 -