|
一周强化
一、一周内容概述
本周学习了氧化还原反应,重点介绍了:化学反应的分类,从得氧和失氧观、化合价升降观、电子转移观分析氧化还原反应,找出氧化还原反应的判断依据和氧化还原的本质;氧化还原反应有关概念,如氧化剂、还原剂、氧化性、还原性、氧化产物、还原产物等;氧化性和还原性强弱的判断方法、常见的氧化剂和还原剂、氧化还原反应的规律。
二、重难点知识剖析
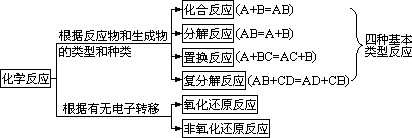
(一)化学反应的分类
(二)元素的化合价
元素原子的最外电子层结构决定了原子间是按一定数目相互化合,元素的原子相互化合的数目叫这种元素的化合价。
1、单质中元素的化合价为0;
2、在化合物中金属元素的化合价全为正值,非金属元素的化合价一般既有负值又有正值;
3、在化合物中,各元素的正、负化合价的代数和为0;
如:原子团的化合价:NO3-、SO42-、SO32-、HSO3-(亚硫酸氢根)、CO32-、HCO3-、ClO3-(氯酸根)、NH4+(铵根)、MnO4-(高锰酸根)、PO43-(磷酸根)。
中心元素的化合价:

4、离子化合物中,元素的化合价与在生成它们的反应中原子得、失电子数目及离子的电荷数在数值上相等,如NaCl:

共价化合物中,元素的化合价与在生成它们的反应中共用电子对的偏向、偏离的对数在数值上相等。如HCl:
共用电子对偏向氯原子,氯元素化合价为-1价;
共用电子对偏离氢原子,氢元素化合价为+1价。
(三)氧化还原反应的特征与本质
1、比较

2、氧化反应与还原反应同时发生,既对立又统一,在反应中化合价上升和下降总数相等,得到电子和失去电子总数相等。
3、特征(或判断依据):元素的化合价是否发生变化。
4、本质:有电子转移(得失或偏移)
5、氧化还原反应与四种基本类型反应的关系为
置换反应全部属于氧化还原反应,复分解反应全部属于非氧化还原反应,有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
例:有下列反应
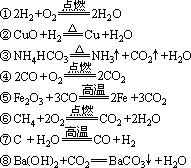
属于四种基本类型反应中:
化合反应的有①④
分解反应的有③
置换反应的有②⑦
复分解反应的有⑧
其中⑤和⑥不属于四种基本类型反应的任一种
属于氧化还原反应的有①②④⑤⑥⑦
属于非氧化还原反应的有③⑧
(四)氧化还原反应中的有关概念

联系:
氧化剂(具有氧化性)→所含元素化合价降低→得电子→被还原剂还原→发生还原反应→得还原产物。
还原剂(具有还原性)→所含元素化合价升高→失电子→被氧化剂氧化→发生氧化反应→得氧化产物。

(五)氧化性和还原性强弱的判断方法
1、根据金属活动性顺序进行判断

2、根据反应方程式进行判断
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
3、根据被氧化或被还原的程度不同进行判断
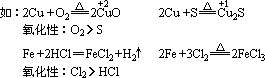
4、根据反应条件判断
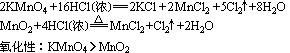
(六)常见的氧化剂和还原剂
常见的氧化剂有: Cl2、O2、S、Fe3+、Cu2+、MnO2、KMnO4、K2Cr2O7、浓H2SO4、HNO3等。
常见的还原剂有: K、Na、Mg、Fe、Fe2+、Cl-、S2-、C、H2、SO2等。
(七)氧化还原反应的规律
1、守恒律
化合价有升必有降,电子有得必有失。对于一个完整的氧化还原反应,化合价升高总数与降低总数相等,失电子总数与得电子总数相等。
2、价态律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要呈现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。如 HCl,既有氧化性(由氢元素表现出的性质),又有还原性(由氯元素表现出的性质)。
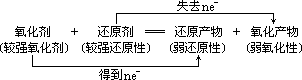
3、强弱律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。
4、转化律
氧化还原反应中,以元素相邻价态间的转化最容易;同种元素不同价态之间若发生反应,元素的化合价只靠近不交叉;同种元素相邻价态间不发生氧化还原反应。
5、难易律
越易失电子的物质,失后就越难得电子,越易得电子的物质,得后就越难失去电子。
一种氧化剂同时和几种还原剂相遇时,还原性最强的先发生反应;一种还原剂遇多种氧化剂时,氧化性最强的先发生反应。
- 返回 -
|

