3、净化和干燥
用饱和食盐水吸收Cl2中的HCl,用浓H2SO4吸收Cl2中的H2O(g),且吸收HCl在前,吸收 H2O(g)在后。
4、收集方法
(1)向上排空气法
(2)排饱和食盐水法(Cl2在饱和食盐水中溶解度较小)
5、验满
(1)湿润的 KI 淀粉试纸(若变蓝,则收集满了)
(2)湿润的蓝色石蕊试纸(若先变红,后褪色,则收集满了)
6、尾气吸收
用NaOH溶液吸收多余的Cl2:Cl2+2NaOH=NaCl+NaClO+H2O
(三)氯气的物理性质
1、通常情况下,氯气呈黄绿色
2、能液化

3、有毒、有剧烈的刺激性气味
闻氯气的方法:用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。
4、比空气重
5、常温下,1体积水溶解2体积氯气(1:2)
(四)氯气的化学性质
1、与金属的反应
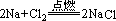
现象:钠在氯气里剧烈燃烧,产生大量的白烟。
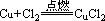
现象:红热的铜丝在氯气里剧烈燃烧,瓶里充满棕黄色的烟,加少量水后,溶液呈蓝绿色。
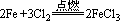
现象:铁丝在氯气里剧烈燃烧,瓶里充满棕色烟,加少量水后,溶液呈黄色。
注意:
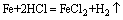 ,由FeCl3和FeCl2中铁元素的化合价可知,氧化性Cl2比HCl强。
,由FeCl3和FeCl2中铁元素的化合价可知,氧化性Cl2比HCl强。
2、与非金属的反应
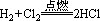
现象:H2在Cl2中安静地燃烧,发出苍白色火焰,瓶口处出现白雾。
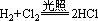
现象:见光爆炸,有白雾产生。
3、与水的反应
Cl2+H2O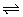 HCl+HClO
HCl+HClO
(1)氯水的组成
氯气的水溶液叫氯水。在常温下,1体积水约溶解2体积氯气,溶解的氯气中只有一部分与水反应。

(2)次氯酸的性质
①不稳定性
 故久制的氯水即为稀盐酸。
故久制的氯水即为稀盐酸。
②强氧化性
能消毒、杀菌,还能使某些染料和有机色素褪色。
③弱酸性
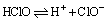
酸性极弱,比H2CO3酸性还弱。
(3)氯水的主要性质
① Cl2的强氧化性
实验室常用新制的氯水代替 Cl2做一部分实验;Cl2无漂白性。
② HCl的酸性
能使紫色石蕊试液变红。
③ HClO的强氧化性
有漂白性,能使紫色石蕊试液先变红后褪色。
(4)氯水的保存:在阴凉处用棕色试剂瓶密封保存。
4、与碱的反应
(1)吸收Cl2:Cl2+2NaOH=NaCl+NaClO+H2O
(2)漂白精:工业上用Cl2与石灰乳(含水量略少于1%)反应
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
①漂白精的主要成分是CaCl2、Ca(ClO)2,有效成分是Ca(ClO)2。
②漂白原理:
Ca(ClO)2+2HCl= CaCl2+2HClO
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
以上可看成强酸制弱酸, HClO的酸性比H2CO3、HCl弱。
③久置失效的原因
Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO
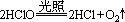
④漂白精的保存:要求密封、避光。
(3)与浓碱在加热条件下反应
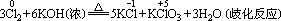
5、与某些还原性化合物的反应
2FeCl2+Cl2=2FeCl3
(五)氯气的用途
1、用于消毒——利用HClO强氧化性
2、制盐酸——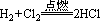 ,HCl溶于水即得盐酸
,HCl溶于水即得盐酸
3、制漂白剂
4、制有机溶剂(如氯仿即CHCl3)、多种农药(如六六六即C6H6Cl6)
(六)氯、溴、碘的性质
1、氯、溴、碘非金属活动性顺序
2Br-+Cl2=2Cl-+Br2 2I-+Cl2=I2+2Cl-
氯、溴、碘非金属活动性顺序:Cl>Br>I
推论:位于前面的非金属能把位于其后面的非金属从其盐溶液(或氢化物)中置换出来
2、卤素单质的物理性质
a、状态:气态(Cl2)液态(Br2)固态(I2)
b、颜色:黄绿色(Cl2)深红棕色(Br2)紫黑色(I2),由浅到深
c、熔、沸点:液态溴易挥发,碘受热易升华
d、溶解性:Cl2溶于水,Br2微溶于水,I2难溶于水;Br2、I2易溶于汽油、酒精、苯、CCl4等有机溶剂,Br2溶于有机溶剂,溶液颜色一般为橙红色,而I2一般是紫红色。
(七)氧化还原反应的特征与本质
1、比较
2、氧化反应与还原反应同时发生,既对立又统一,在反应中化合价上升和下降总数相等,得到电子和失去电子总数相等。
3、特征(或判断依据):元素的化合价是否发生变化。
4、本质:有电子转移(得失或偏移)
5、氧化还原反应与四种基本类型反应的关系为
置换反应全部属于氧化还原反应,复分解反应全部属于非氧化还原反应,有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
(八)氧化还原反应中的有关概念

联系:
氧化剂(具有氧化性)→所含元素化合价降低→得电子→被还原剂还原→发生还原反应→得还原产物。
还原剂(具有还原性)→所含元素化合价升高→失电子→被氧化剂氧化→发生氧化反应→得氧化产物。

