19、向盛有KI溶液的试管中加入少许CCl4后滴加氯水(主要成分为Cl2),CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写)

(2)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目。
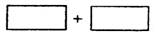
(3)把KI换成KBr,则CCl4层变为__________色:继续滴加氯水,CCl4层的颜色没有变化。由此可知,Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________。
|