20、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
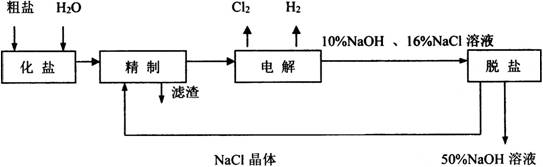
依据上图,完成下列填空:
(1)写出通电条件下电解饱和食盐水的化学方程式______________________________。
(2)为有效除去粗盐中的Ca2+、Mg2+、SO42-杂质,精制过程中加入试剂的合理顺序为__________。
A.NaOH溶液、Na2CO3溶液、钡试剂、盐酸
B.NaOH溶液、钡试剂、Na2CO3溶液、盐酸
C.钡试剂、NaOH溶液、Na2CO3溶液、盐酸
(3)钡试剂可以是__________。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为了保证杂质能够完全除去,除杂试剂均稍过量。判断钡试剂已经过量的方法是________________________________________。
(5)请写出精制过程中加入适量盐酸时发生反应的离子方程式____________________。
(6)下表是NaOH、NaCl在不同温度下的溶解度(单位:g/100g水):
温度(℃) |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
70℃ |
80℃ |
90℃ |
100℃ |
NaOH |
42 |
51 |
109 |
119 |
129 |
145 |
174 |
299 |
314 |
329 |
347 |
NaCl |
35.7 |
35.8 |
36 |
36.3 |
36.6 |
37 |
37.3 |
37.8 |
38.4 |
39 |
39.8 |
由此可知:
脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________、冷却、__________(填写操作名称)除去NaCl;该工业流程中可循环利用的物质是__________。
|