19.(8分)硫酸锰铵[(NH4)2SO4·MnSO4·nH2O]是浅粉色晶体,易溶于水,在农业上用作微量元素肥料.实验室由MnO2制备硫酸锰铵的实验步骤如下:
①在烧杯中加入20.0 ml,1 mol·L-1硫酸并加入a g草酸微热,再慢慢分次加入a g MnO2,盖上表面皿,使其充分反应.
②煮沸溶液并趁热过滤.
③往热滤液中加入b g硫酸铵,待硫酸铵全部溶解后,在冰水浴中冷却,30分钟后过滤,并用少量乙醇溶液洗涤两次,用滤纸吸干或放在表面皿上干燥.
④称得产品质量为c g.
根据以上信息,回答下列问题:
(1)配制100 mL 1 mol·L-1硫酸溶液时,需要的玻璃仪器除烧杯、玻璃棒、量筒外,还需要__________.
(2)MnO2与草酸的硫酸溶液反应的化学方程式为____________.
(3)用乙醇洗涤的目的是___________________.
(4)为确定其化学式,现对产品在氮气中进行热重分析,已知在371℃下结晶水会全部失去.其TG曲线如图所示.
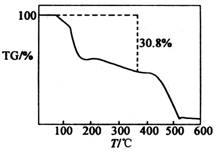
(TG=固体样品的剩余质量/固体样品的起始质量×100%)
则(NH4)2SO4·MnSO4·nH2O中的n=______(填数字,取整数).
|