|
21.(14分)现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:
(1)在A、B、C、D四种元素中第一电离能最小的是___________,电负性最大的是___________ (用相应的元素符号表示).
(2)写出DA2的水化物在水中的电离方程式___________.DA3是___________分子(填“极性”或“非极性”).
(3)A、C的简单氢化物中,哪种物质的沸点高,原因是什么? ___________________________
(4)若[E(NH3)4]2+具有对称的空间构型,且当[E(NH3)4]2+中的两个NH3分子被两个Cl-取代时,能得到两种不同结构的产物,则[E(NH3)4]2+的空间构型为_________ (填序号).
a.正四面体 b.平面正方形 c.三角锥形 d.V形
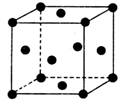
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为a pm,密度为dg·cm-3(1pm=10-10cm).写出阿伏加德罗常数NA的表达式___________.(用M、a、d表示)
|