14. C
A.第4min的化学平衡常数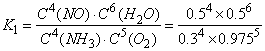 、第8min时达到化学平衡的平衡常数
、第8min时达到化学平衡的平衡常数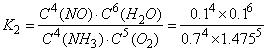 .二者二者数值不相等。错误。
.二者二者数值不相等。错误。
B.反应从开始到2min时Δc(NH3)=0.2mol/L,所以根据方程式中与氧气的关系,氧气的浓度改变数值为5/4×0.2mol/L=0.25mol/L。因此a=1.35mol/L.在第2min时改变了某一条件,使反应速率大大加快。改变的条件可能是使用催化剂或升高温度。错误。
C.反应在第2min到第4min时:
V(NH3)=(0.6-0.3)mol/L÷2min=0.15mol/(L·min);
V(O2)=“5/4”V(NH3)=5/4×0.15mol/(L·min)=0.1875mol/(L·min)。正确。
D.在开始反应的前2min内,NH3发生反应的物质的量为0.2mol.根据热化学方程式可知:该反应放出0.05QKJ的热量。错误。