15、(7分)某研究小组为了制备Na2S2O3,做了如下实验:已知Na2S2O3易溶于水,遇酸易分解。
I.实验原理:Na3SO3(aq)+S(s)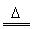 Na2S2O3(aq) Na2S2O3(aq)
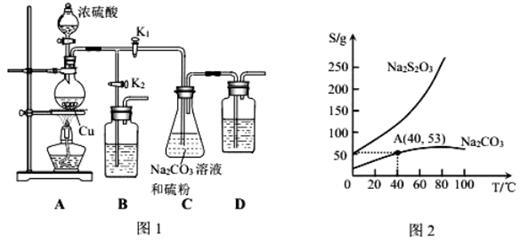
Ⅱ.实验装置:如图1所示,有关物质的溶解度曲线如图2所示:
Ⅲ.实验步骤:
(1)检查装置气密性,按图1所示加入试剂,其中装置D的作用是_____。写出C装置中发生的化学方程式:_________________________。
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
(3)当C中溶液的pH接近7时,打开K2、关闭K1并停止加热。
(4)将C中为40℃含50g水的饱和Na2S2O3·5H2O,可得Na2S2O3·5H2O_____g.
|