|
17.(11分)工业上以β—锂辉石(主要成分为Li2O·Al2O3·4SiO2)为原材料制备Li2CO3的工艺流程如下:
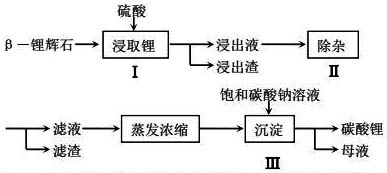
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4;Li2SO4、LiOH和Li2CO3在303K下的溶解度分别为34.2g、12.7g和1.3g.
(1)步骤Ⅰ中,酸浸后得到的酸性溶液中含有Li+、SO42-,另含有Al3+、Fe3+、Fe2+、Mg2+、Ca2+等杂质,需在搅拌下加入石灰石以调节溶液的PH到6.0~6.5,过滤,能除去的部分杂质离子是_____,然后分离得到浸出液。
(2)步骤Ⅱ中,将适量的H2O2溶液、石灰乳和Na2CO3溶液依次加入浸出液中,可除去Fe2+等杂质金属离子,用H2O2将Fe2+除去的离子反应方程式_____________;步骤Ⅱ所得滤渣主要成分的化学式是_____________.
(3)Na2SO4·10H2O是工业生产的一种重要化工原料.步骤Ⅲ所得母液溶质主要是Na2SO4和少量NaOH.可以向母液中加入适量的_______,再通过_____、_______、过滤、洗涤,得到Na2SO4·10H2O晶体。
|