|
20.(15分)研究CO、NO2、SO2等大气污染气体的处理具有重要意义。
(1)I2O5可使H2S、CO、HCl等氧化,常用于定量测定CO的含量.已知:
2I2(s)+5O2(g)=2I2O5(s) △H=-75.56kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:__________________________.
(2)已知反应: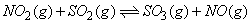 的△H=-41.8kJ·mol-1 的△H=-41.8kJ·mol-1
一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________.
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=________.
(3)CO可用于合成甲醇,反应方程式为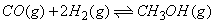 . .
①该反应在40℃和60℃时的平衡常数分别为K1和K2,若K1大于K2,则该反应为_____反应.(填“放热”或“吸热”)
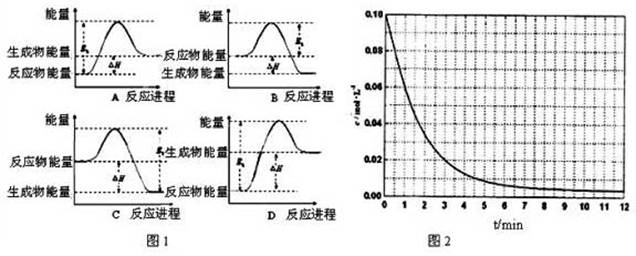
②该反应的焓变为△H,活化能为E0,下列能量关系图(图1)合理的是______.
(4)某温度时,根据的H2浓度随时间的变化曲线,请在同一图(图2)中绘出CH3OH浓度随时间的变化曲线.
|