|
37.【化学——选修3:物质结构与性质】(15分)
铁与人类密切相关,几乎无处不在,地壳中大约5%是铁,是含量仅次于铝的金属.它的单质及化合物在科学研究和工业生产中具有许多用途.根据所学知识回答下列问题:
(1)基态铁原子的电子占据最高的能层的符号为_______,与铁同周期的所有副族元素的基态原子中,最外层电子数与铁相同的元素有_______种.
(2)下列关于铁的说法,正确的是_______________(填选项字母)
A.基态铁原子的电子排布式1s22s22p63s23p103d24s2肯定违反了泡利原理
B.铁属于黑色金属,在周期表中属于d区元素
C.铁丝可用于焰色反应实验时蘸取待测物,是由于铁在光谱图中无特征的谱线
D.Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有的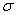 键数是5NA 键数是5NA
(3)某铁的化合物结构简式如下图所示
①组成上述化合物各元素原子电负性由大到小的顺序为____________________________.
②上述化合物中氮原子的杂化方式为______________________________.
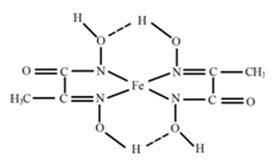
③在上图中用“→”标出亚铁离子的配位键.
(4)类卤素离子SCN-可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H﹣S﹣C≡N )和异硫氰酸(H﹣N=C=S),这两种酸中沸点较高的是___________________.
(5)铁单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示,若铁原子的半径是rcm,则这两种晶体密度之比是___________________.

|