26、(14分)硫酸亚铁品体(FeSO4·7H2O)是制备多种药物的重要原料,受热易分解。已知:SO3的熔点为16.8℃,沸点是44.8℃,能被浓硫酸充分吸收,溶于水放出大量热,易形成酸雾;三氧化硫是很强的氧化剂,特别是在高温时能氧化硫、磷、铁、锌以及溴化物、碘化物等。
(1)甲组同学设计如下图所示装置,通过实验检验硫酸亚铁晶体的分解产物。装置B中可观察到的现象是__________,由此可知草酸亚铁品体分解的产物中有__________。装置C的作用______________________________。
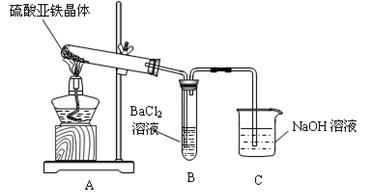
(2)乙组同学认为硫酸亚铁品体分解的产物中还含有SO2,鉴于SO3有很强的氧化性,要验证验证产物中还含有SO2,需排除SO3的干扰,选用甲组实验中的装置A、C和下图所示的部分装置进行实验。
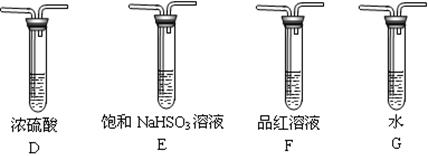
①乙组同学的实验装置中,依次连接的合理顺序为A、__________、C。
②能证明硫酸亚铁品体分解产物中有SO2的现象是____________________。
(3)设计实验:
①证明分解产物中含有三价铁____________________。
②测定H2SO3的第二步电离常数Ka2____________________。
|