27、(14分)氯化亚铜(CuCl)广泛用于化工、印染、有机合成等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(丰要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜的工艺过程如下:
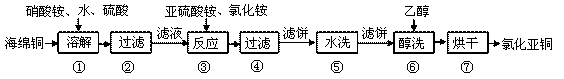
回答下列问题:
(1)CuCl中Cu元素的化合价为__________。
(2)步骤①中N元素被还原为最低价,则Cu溶解的离子方程式为____________________,溶解温度应控制在60~70℃,原因是____________________。
(3)写出步骤③中主要反应的离子方程式____________________。(NH4)2SO3要适当过量,目的有:保证Cu2+的还原速率,____________________。己知NH4Cl、Cu2+的物质的量之比[n(NH4Cl)/n(Cu2+)]与Cu2+沉淀率的关系如下图所示,当氯化铵用量增加到一定程度后氯化亚铜的沉淀率减少,原因是______________________________。

(4)步骤⑥加入乙醇洗涤的目的是______________________________。
(5)氯化亚铜的定量分析:
①称取样品0.250g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解。
②用0.100mol·L-1硫酸铈[Ce(SO4)2]标准溶液滴定。
已知:CuCl+FeCl3=CuCl2+FeCl2、Fe2++Ce4+=Fe3++Ce3+。
三次平行实验结果如下(平行实验结果相差不能超过1%):
平行实验次数 |
1 |
2 |
3 |
0.250g样品消耗硫酸铈标准溶液的体积(mL) |
24.35 |
24.05 |
23.95 |
则样品中CuCl的纯度为__________(结果保留三位有效数字)。
|