28.(15分)甲烷和二氧化碳都是温室气体。甲烷和二氧化碳催化重整的反应为:
CH4(g)+CO2(g) 2CO(g)+2H2(g) △H 2CO(g)+2H2(g) △H
(1)己知H2(g)、CO(g)、CH4(g)的燃烧烧热分别为-285.8kJ/mol、-283.0kJ/mol、-890.3kJ/mol,甲烷和二氧化碳催化重整的反应的△H=__________kJ/mol。
(2)某恒温恒容密闭容器中,投入2mol CH4和2mol CO2下列图像正确且能说明反应达到化学平衡的是__________;
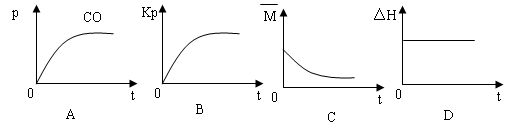
若该反应的平衡常数Kp=1×102(kPa)2,反应达到甲衡时p(CH4)=10.0kPa,则平衡混合气体中CO的物质的量分数为__________(Kp是用平衡分压代替平衡浓度计算所得平衡常数,分压=总压×物质的量分数)。
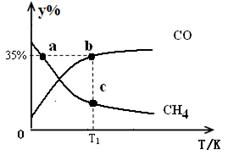
(3)某恒容密闭容器中,投入2mol CH4和2mol CO2,不同温度下平衡体系中CH4和CO的物质的量百分数(y%)随温度变化如下图所示,则c点CH4的物质的量分数为__________;v逆:a__________b点(填“>”“<”或“=”),理由是:______________________________。
(4)某研究小组将两个氢氧燃料电池串联后作为电源,进行饱和氯化钠溶液(滴有几滴酚酞)电解实验,如图所示。
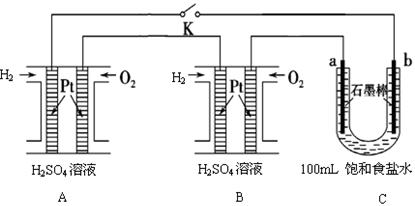
①该电池的正极反应式为____________________;
②与石墨电极比较,Pt电极的优点是______________________________(列出一条即可)
③若每个电池的电压均为1.50V,电解一段时间后,测得C溶液pH为13时,共输出__________kJ电能(保留3位小数)。(己知法拉第常数F=9.65×104C·mol-1)。
|